
1. 镁和铝的性质
 |
|||
 |
|||
教与学方案 笔记与反思
【自学反馈】
一)镁和铝的复习
3.注重图像在化学解题中的应用。
2.掌握镁和铝的化合物的性质,并重点掌握铝及其化合物的两性;
1.掌握镁和铝单质的化学性质,并重点掌握镁和铝的特性;
课外作业
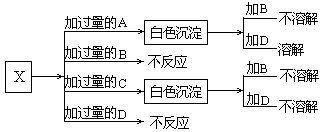
13、A、B、C和D分别是NaNO3、NaOH、HNO3和Ba(NO3)2四种溶液中的一种。现利用另一种溶液X,用如下图所示的方法,即可将它们一一确定。试确定A、B、C、D、X各代表何种溶液。
A:_______ B:_______ C:_______ D:_______ X:_______
14、试样X由氧化亚铁和氧化铜组成.取质量相等的两份试样按下图所示进行实验:

(1)请写出步骤③中所发生的全部反应的离子方程式.
(2)若全部的溶液Y和全部的粉末Z充分反应后,生成的不溶物W的质量是m,则每份试样X中氧化铜的质量为_____________.(用m表示)
15、现有一定量含有Na2O杂质的Na2O2试样.请从下图中选用适当 应物只有CaCO3固体,6摩尔/升,盐酸和蒸馏水).

请填写下列空白:
(1)写出实验中Na2O2和Na2O分别发生反应的化学方程式______________。
(2)应选用的装置是(只要求写出图中装置的标号)______________________。
(3)所选用装置的连接顺序应是(填各接口的字母;连接胶管省略)_________。
16、取一定量的Na2CO3、NaHCO3和Na2SO4混合物与250mL 1.00mol?L-1过量盐酸反应,生成2.016L
CO2(标准状况),然后加入500mL 0.100mol?L-1Ba(OH)2溶液,得到沉淀的质量为2.33g,溶液中过量的碱用10.0mL 1.00ml?L-1盐酸恰好完全中和。计算混合物中各物质的质量。
第十二章 几种重要的金属
第二课时 镁 铝及其化合物
【考纲要求】
1、下列灭火剂能用于扑灭金属钠着火的是
A、干冰灭火剂 B、黄砂
C、干粉(含NaHCO3)灭火剂
D、泡沫灭火剂
2.用铜锌合金制成的假金元宝欺骗行人的事件屡有发生。下列不易区别其真伪的方法是
A、测定密度 B、放入硝酸中
C、放入盐酸中 D、观察外观
3、下列叙述中,正确的是
A、含金属元素的离子不一定都是阳离子
B、在氧化还原反应中,非金属单质一定是氧化剂
C、某元素从化合态变为游离态时,该元素一定被还原
D、金属阳离子被还原不一定得到金属单质
4、关于晶体的下列说法正确的是
A、在晶体中只要有阴离子就一定有阳离子
B、在晶体中只要有阳离子就一定有阴离子
C、原子晶体的熔点一定比金属晶体的高
D、分子晶体的熔点一定比金属晶体的低
5、已知铍(Be)的原子序数为4.下列对铍及其化合物的叙述中,正确的是
A、铍的原子半径大于硼的原子半径
B、氯化铍分子中铍原子的最外层电子数是8
C、氢氧化铍的碱性比氢氧化钙的弱
D、单质铍跟冷水反应产生氢气
6、制印刷电路时常用氯化铁溶液作为“腐蚀液”:发生的反应为2FeCl3+Cu=2FeCl2+CuCl2,向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列结果不可能出现的是
A、烧杯中有铜无铁 B、烧杯中有铁无铜
C、烧杯中铁、铜都有 D、烧杯中铁、铜都无
7、将铁屑溶于过量盐酸后,再加入下列物质,会有三价铁生成的是
A、硫酸 B、氯水 C、硝酸锌 D、氯化铜
8、由锌、铁、铝、镁四种金属中的两种组成的混合物10g,与足量的盐酸反应产生的氢气在标准状况下为11.2L,则混合物中一定含有的金属是
A、锌 B、铁 C、铝 D、镁
9、把a g铁铝合金粉末溶于足量盐酸中,加入过量NaOH溶液。过滤出沉淀,经洗涤、干燥、灼烧,得到红棕色粉末的质量仍为a g,则原合金中铁的质量分数为
A、70% B、52.4% C、47.6% D、30%
10、将等物质的量的镁和铝相混合,取等质量该混合物四份,分别加到足量的下列溶液中,充分反应后,放出氢气最多的是
A、3摩/升HCl B、4摩/升HNO3
C、8摩/升NaOH D、18摩/升H2SO4
11、某二价金属碳酸盐和碳酸氢盐的混合物跟足量盐酸反应,消耗H+和产生CO2的物质的量之比为6:5,该混合物中碳酸盐和碳酸氢盐的物质的量之比为
A、1:1 B、1:2 C、1:3 D、1:4
12、铜和镁的合金4.6g完全溶于浓硝酸,若反应中硝酸被还原只产生4480mL的NO2气体和336mL的N2O4气体(都已折算到标准状况),在反应后的溶液中,加入足量的氢氧化钠溶液,生成沉淀的质量为
A、9.02g B、8.51g C、8.26g D、7.04g
 1、用下面两种方法可以制得白色的Fe(OH)2沉淀。
1、用下面两种方法可以制得白色的Fe(OH)2沉淀。
方法一:用不合Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备。
(1)用硫酸亚铁晶体配制上述FeSO4溶液时还需加入_________。
(2)除去蒸馏水中溶解的O2常采用_________的方法。
(3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不合O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是_________。
方法二:在如图装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备。
(1)在试管I里加入的试剂是_________。
(2)在试管Ⅱ里加入的试剂是_________。
(3)为了制得白色Fe(OH)2沉淀,在试管I和Ⅱ中加入试剂,打开止水央,塞紧塞子后的实验步骤是_________。
(4)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理出是_________。
思维方法: 。
展望高考:
【巩固练习】
课堂反馈
例6、14g铁粉全部溶于稀HNO3溶液中,恰好反应,放出NO气体后得到溶液1L,称量所得溶液,发现比原稀HNO3增重8g。求 ① 所得溶液中金属离子的物质的量浓度。② 原稀HNO3溶液的物质的量浓度(体积变化忽略不计)。
解题思路: 。
易错点: 。
【考题再现】
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com