
1. 常识性了解金属在自然界中的分布、存在形态以及储量;
25、在2L Fe2(SO4)3和CuSO4的混合溶液中,加入30g纯铁粉,最后得到2L 0.25mol/L的FeSO4溶液和26g固体沉淀物。求原混合溶液中Fe2(SO4)3和CuSO4的物质的量的浓度。
第十二章 几种重要的金属
第四课时 金属的冶炼
【考纲要求】
24、在Fe2O3和Fe的混合物中加入足量的稀硫酸,充分反应后生成FeSO4溶液和H2。若生成的Fe2+与H2的质量比为112:1,则
(1)Fe2+与H2的物质的量之比为________
(2)若将生成的Fe2+分成4等份,就其来源而言,其中____份来自Fe与H+的反应,________份是Fe3+的还原产物。
(3)原混合物中Fe2O3与Fe的质量比为10:____
23、固体A由下列离子中的部分离子组成:Cu2+、Ba2+、Fe3+、Na+、Cl-、HCO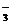 、CO
、CO 。给固体A加水得一无色溶液,再向溶液中加入稀硫酸无反应。从以上实验可得出什么推断,其结论是什么。
。给固体A加水得一无色溶液,再向溶液中加入稀硫酸无反应。从以上实验可得出什么推断,其结论是什么。
22、在单质、氧化物、酸、碱、盐中选取原料制取Fe(NO3)2,写出三个可行反应的化学方程式(不要重复同一反应类型):
(1)___________________________
(2)____________________________
(3)_______________________________

 反应完成后在溶液中滴入NH4SCN溶液使溶液显血红色
反应完成后在溶液中滴入NH4SCN溶液使溶液显血红色
21、用稀硫酸溶解FeS和Fe(OH)3的混合物28.3克可得1.6克硫,混合物中FeS的质量是 克。当FeS为
20、今有四种处于固态的物质:镁、金刚石、干冰、氟化镁。问下列四项性质的叙述各适用于哪种物质?
由分子间力结合而成,熔点很低,是___;电的良导体,有延展性,是___;由共价键组成的网状晶体,熔点很高,是___;非导体,但熔融后可以导电的,是___。
19、某化工厂为消除所排出的废气中Cl2对环境的污染,将含Cl2的废气通过含过量铁粉的FeCl2溶液即可有效地除去Cl2。这一处理过程可用化学方程式表示为:
________________________________________________ 。
处理过程中消耗的原料是铁粉还是FeCl2?
________________________________________________。
18、下列各组溶液,均含有等物质的量的溶质,如将3种溶液完全混合后,不会产生沉淀的是( )
(A)NaAlO2、NH4Cl、HCl (B)FeCl3、KSCN、HCl
(C)CaCl2、NaHCO3、NaOH (D)AlCl3、Ba(OH)2、HNO3
课外作业
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com