
6、某元素的激发态原子的电子排布式为1s 2s
2s 2p
2p 3s
3s 3p
3p 4s
4s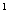 ,则该元素基态原子的电子排布式为
;元素符号为
。
,则该元素基态原子的电子排布式为
;元素符号为
。
5、若某基态原子的外围电子排布为4d15s2,则下列说法正确的是
A.该元素基态原子中共有3个电子 B.该元素原子核外有5个电子层
C.该元素原子最外层共有3个电子
D.该元素原子M能层共有8个电子
4、请根据构造原理,写出下列基态原子的电子排布式
(1)N (2)Ne
(3)Br (4)Ca
3、当碳原子的核外电子排布由1s22s22p2转变为1s22s12p3时,下列说法正确的是
A.碳原子由基态变为激发态 B.碳原子由激发态变为基态
C.碳原子要从外界环境中吸收能量 D.碳原子要向外界环境释放能量
2、生活中的下列现象与原子核外电子发生跃迁有关的是( )
A、钢铁长期使用后生锈 B、节日里燃放的焰火
C、金属导线可以导电 D、夜空中的激光
1、同一原子的基态和激发态相比较 ( )
A、基态时的能量比激发态时高 B、基态时比较稳定
C、基态时的能量比激发态时低 D、激发态时比较稳定
1、依据:构造原理中的排布顺序,其实质是各能级的能量高低顺序可由公式得出:ns < (n-2)f < (n-1)d < np
3、以下能级符号正确的是 ( )
A 6s B 2d C 3f D 7p
教 案
|
课题:第一节 原子结构(2) |
授课班级 |
|
||||||||||||||||||||||||||||||||||||||||||||||
|
课 时 |
|
|||||||||||||||||||||||||||||||||||||||||||||||
|
教 学 目 的 |
知识 与 技能 |
1、了解原子结构的构造原理,能用构造原理认识原子的核外电子排布 2、能用电子排布式表示常见元素(1-36号)原子核外电子的排布 3、知道原子核外电子的排布遵循能量最低原理 4、知道原子的基态和激发态的涵义 5、初步知道原子核外电子的跃迁及吸收或发射光谱,了解其简单应用 |
||||||||||||||||||||||||||||||||||||||||||||||
|
过程 与 方法 |
复习和沿伸、动画构造原理认识核外电子排布,亲自动手书写,体会原理 |
|||||||||||||||||||||||||||||||||||||||||||||||
|
情感 态度 价值观 |
充分认识原子构造原理,培养学生的科学素养,有利于增强学生学习化学的兴趣。 |
|||||||||||||||||||||||||||||||||||||||||||||||
|
重 点 |
电子排布式、能量最低原理、基态、激发态、光谱 |
|||||||||||||||||||||||||||||||||||||||||||||||
|
难 点 |
电子排布式 |
|||||||||||||||||||||||||||||||||||||||||||||||
|
知 识 结 构 与 板 书 设 计 |
三、构造原理 1.构造原理:绝大多数基态原子核外电子的排布的能级顺序都遵循下列顺序:1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s…… 2、能级交错现象(从第3电子层开始):是指电子层数较大的某些轨道的能量反低于电子层数较小的某些轨道能量的现象。 电子先填最外层的ns,后填次外层的(n-1)d,甚至填入倒数第三层的(n-2)f的规律叫做“能级交错” 3.能量最低原理:原子核外电子遵循构造原理排布时,原子的能量处于最低状态。即在基态原子里,电子优先排布在能量最低的能级里,然后排布在能量逐渐升高的能级里。 4、对于同一电子亚层(能级)(等价轨道),当电子排布为全充满、半充满或全空时,原子是比较稳定的。 5、基态原子核外电子排布可简化为:[稀有气体元素符号]+外围电子(价电子、最外层电子) 四、基态与激发态、光谱 1、基态-处于最低能量的原子。 激发态-当基态原子的电子吸收能量后,电子会跃迁到较高能级,变成激发态原子。 基态与激发态的关系: 2、不同元素的原子发生跃迁时会吸收或释放不同的光,可以用光谱仪摄取各种元素的电子的吸收光谱或发射光谱,总称原子光谱 3、光谱分析-利用原子光谱线上的特征谱线来鉴定元素。 |
|||||||||||||||||||||||||||||||||||||||||||||||
|
教学过程 |
||||||||||||||||||||||||||||||||||||||||||||||||
|
教学步骤、内容 |
教学方法、手段、师生活动 |
|||||||||||||||||||||||||||||||||||||||||||||||
|
[课前练习]理论研究证明,在多电子原子中,电子的排布分成不同的能层,同一能层的电子,还可以分成不同的能级。能层和能级的符号及所能容纳的最多电子数如下: [投影] 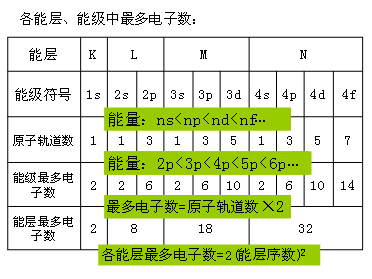 [思考]钾原子的电子排布为什么是2、8、8、1而非2、8、9? [板书]三、构造原理 [投影]图1-2构造原理:  [讲]在多电子原子中,电子在能级上的排布顺序:电子最先排布在能量低的能级上,然后依次排布在能量较高的能级上。电子的排布遵循构造原理 [板书]1.构造原理:绝大多数基态原子核外电子的排布的能级顺序都遵循下列顺序:1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s…… [讲]构造原理揭示了原子核外电子的能级分布。从中可以看出,不同能层的能级有交错现象,如E(3d)>E(4s)、E(4d)>E(5s)、E(5d)>E(6s)、E(6d)>E(7s)、E(4f)>E(5p)、E(4f)>E(6s)等。 [板书]2、能级交错现象(从第3电子层开始):是指电子层数较大的某些轨道的能量反低于电子层数较小的某些轨道能量的现象。 电子先填最外层的ns,后填次外层的(n-1)d,甚至填入倒数第三层的(n-2)f的规律叫做“能级交错” [知识拓展]1、主量子数和角量子数之和越大,能量越高 2、主量子数和角量子数之和相等时,主量子数越大,能量越高 例如,4s轨道主量子数和角量子数之和为4,3d轨道主量子数和角量子数之和为5,于是4s轨道的能量低于3d轨道的能量;而3d轨道和4p轨道主量子数和角量子数之和均为5,但4p轨道的主量子数更大,于是4p轨道的能量高于3d轨道的能量 [讲]自然界一个普遍的规律是“能量越低越稳定”。原子中的电子也是如此。在不违反保里原理的条件下,电子优先占据能量较低的原子轨道,使整个原子体系能量处于最低,这样的状态是原子的基态。 [板书]3.能量最低原理:原子核外电子遵循构造原理排布时,原子的能量处于最低状态。即在基态原子里,电子优先排布在能量最低的能级里,然后排布在能量逐渐升高的能级里。 [讲]一切自然变化进行的方向都是使能量降低,因为能量较低的状态比较稳定,此谓能量最低原理。人是自然界的一员,我想也应该适用于此原理。所以人才会通过各种方式发泄和排解自己的各种能量。这其中包括喜怒哀乐等情绪以运动。不过释放能量的方式还是要注意的,如小孩本身不能存储过多的情绪,想哭就哭、想笑就笑,没有太大的冲击;而成人能够容纳很多的能量,所以感情更深沉丰富。但也有弊端,如果这些能量不能合理的排解,一旦冲垮理智的大坝,江河泛滥,后果不堪设想。我想在我们提升自身修养与胸怀的同时,一定要时刻注意心理能量的警戒线,及时合理宣泄自身的情绪。有容乃大,无欲则刚。 [投影]部分原子的电子排布式,空着的自己填上:
[思考与交流]查元素周期表中铜、金、银外围电子排布,它们是否符合构造原理,你从中总结出什么规律? Cu:[Ar]3d104s1 Ag[Kr] 4d105s1 Au[Xe] 5d106s1,如Cu根据构造原理先排4s再排3d,实际上采取了3d全充满,4s半充满的状态。 [板书] 4、对于同一电子亚层(能级)(等价轨道),当电子排布为全充满、半充满或全空时,原子是比较稳定的。 [投影]相对稳定的状态有:全充满:p6,d10,f14。全空:p0,d0,f0。半充满:d5,f7。 [思考与交流]元素周期表中钠的电子排布写成[Ne]3s1,[]是什么意义?模仿写出8号、14号、26元素简化的电子排布式? []稀有气体结构,O:[He] 2s22p4 Si:[Ne] 3s23p2 Fe:[Ar] 3d64s2。 [讲]上式方括号里的符号的意义是:该元素前一个周期的惰性气体电子排布结构 [板书]5、基态原子核外电子排布可简化为: [稀有气体元素符号]+外围电子(价电子、最外层电子) [讲]即将基态电子的原子排布式中与稀有气体相同的部分用该稀有气体的元素符号表示。 [投影小结]构造原理中排布顺序的实质------各能级的能量高低顺序 1)相同能层的不同能级的能量高低顺序 : ns<np<nd<nf 2)英文字母相同的不同能级的能量高低顺序:1s<2s<3s<4s;2p<3p<4p; 3d<4d 3) 不同层不同能级可由下面的公式得出: ns < (n-2)f < (n-1)d < np (n为能层序数) [随堂练习]写出17Cl(氯)、21Sc(钪)、35Br(溴)的电子排布 氯:1s22s22p63s23p5 钪:1s22s22p63s23p63d14s2 溴:1s22s22p63s23p63d104s24p5 [知识拓展]原子最外层、次外层及倒数第三层最多容纳电子数的解释: 2.支撑“宇宙大爆炸”理论的重要事实之一是 ( ) A.宇宙原子总数的88.6%是氢 B.地球上的元素绝大多数是金属 C.普鲁特“氢是元素之母”的预言 D.宇宙中存在少量稀有气体分子 同步练习册答案 湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区 违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com版权声明:本站所有文章,图片来源于网络,著作权及版权归原作者所有,转载无意侵犯版权,如有侵权,请作者速来函告知,我们将尽快处理,联系qq:3310059649。 ICP备案序号: 沪ICP备07509807号-10 鄂公网安备42018502000812号 |