
9.向体积Va的0.05 mol•L −1 NH3•H2O溶液中加入体积为Vb的0.05 mol•L −1 HCl溶液,下列错误的是( )
A.Va>Vb时:c(NH3•H2O) +c( NH+4)>c(Cl-)
B.Va=Vb时:c(NH3•H2O)+ c(OH-)=c(H+)
C.Va<Vb时:c(NH+4)>c(Cl-)>c(H+)>c(OH-)
D.Va与Vb任意比时:c(NH+4) + c(H+)=c(OH-)+ c(Cl-)
8.下列说法中不正确的是 ( )
A.将纯水加热至较高温度,水的离子积变大,pH变小,呈中性
B.25 ℃时,0.1 mol•L −1氨水和0.05 mol•L −1氨水中c(OH-)之比是2∶1
C.相同温度下,pH=2的醋酸溶液与pH=2的盐酸中c(H+)之比为1:l
D.向盛有少量Mg(OH)2沉淀的试管中加入NH4Cl浓溶液,振荡,沉淀会逐渐溶解
7.下列叙述中正确的是( )
A.同一主族元素的气态氢化物,其相对分子质量越大,对应的熔、沸点一定越高
B.若弱酸HA的酸性强于弱酸HB,则同浓度钠盐溶液的pH:NaA<NaB
C.若R2-离子和M+离子的电子层结构相同,则原子序数:R>M
D.升高温度可加快反应速率,其主要原因是反应物分子能量增加,单位体积活化分子的数目增多,活化分子的百分数不变,使得有效碰撞次数增多
6.用NA表示阿伏加德罗常数。下列说法正确的是( )
A.标准状况下,22.4 L己烷中共价键数目为19NA
B.1 L 1 mol/L FeCl3溶液中含有NA个Fe3+
C.由CO2和O2组成的混合物中共有NA个分子,其中氧原子数为2NA
D.足量C12与5.6 g Fe完全反应时,转移的电子数为0.2NA
31. (12分)取甲、乙、丙、丁四支洁净的试管,按照下表中顺序依次加入有关物质并进行有关处理,回答下列问题:
|
试管编号 |
甲 |
乙 |
丙 |
丁 |
|
淀粉溶液3mL |
+ |
+ |
+ |
|
|
新鲜的小麦淀粉酶滤液2mL |
+ |
- |
+ |
|
|
35℃的水浴5分钟 |
+ |
+ |
+ |
+ |
|
碘液1滴 |
+ |
+ |
- |
|
|
斐林试剂2mL |
- |
- |
+ |
|
|
沸水浴加热5分钟 |
- |
- |
+ |
+ |
(注:“+ ”表示加入物质或相关处理,“- ”表示不加物质或不做处理)
(1) 用甲、乙试管做验证酶具有催化作用的实验,则乙试管中还应加入 ,乙试管内的实验现象是 。
(2) 用丙、丁试管做验证酶具有专一性的实验,则丁试管内应先后加入 (从下面的①-⑧中选择序号填空)。
①碘液1滴 ②斐林试剂2mL ③双缩脲试剂2mL ④二苯胺试剂2mL
⑤淀粉溶液3mL ⑥蔗糖溶液3mL ⑦小麦淀粉酶滤液2mL ⑧清水2mL
该实验的实验变量是 。
该实验的原理是:① 。
② 。
30. (30分)
Ⅰ.(18分)某实验室做了下图所示的实验研究,已知小鼠体细胞的染色体数目为40条。分析回答下列问题:
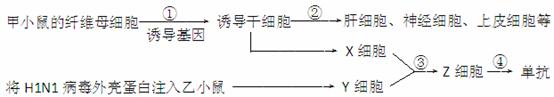
(1)与纤维母细胞相比,过程①形成的诱导干细胞的全能性 。
(2)过程②是 过程,其根本原因是 。
(3)要获得Y细胞,将H1N1病毒外壳蛋白质注射到小鼠体内,实质是在小鼠体内引发
过程,Y细胞一般是从小鼠 中采集的。
(4)过程③除了采用诱导植物细胞原生质体融合的方法外,还可以用 诱导。
(5)产生单抗Z细胞叫 ,它从培养液中吸收氨基酸的方式和分泌单抗到细胞外的方式 (相同/不同)。
(6)培养中的Z细胞最多含有 条染色体。
Ⅱ.(12分)细胞周期包括分裂间期(分期G1、S期和G2期)和分裂期(M期)。下图标注了甲动物(体细胞染色体数为12条)肠上皮细胞的细胞周期各阶段的时长及DNA含量。请回答下列问题:
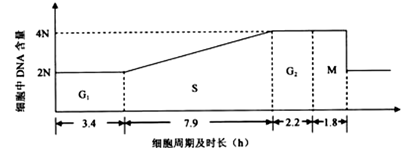
(1)若用含放射性同位素的胸苷(DNA复制的原料之一)短期培养甲动物肠上皮细胞后,处于S期的细胞都会被标记。洗脱含放射性同位素的胸苷,换用无放射性的新鲜培养液培养,定期检测。预计最快约 h后会检测到被标记的M期细胞。
(2)从被标记的M期细胞开始出现到其所占M期细胞总数的比例达到最大值时,所经历的时间为 期的时间(填图中字母),处于该期的一个细胞中染色体数目的变化情况是 。
(3)若向甲动物肠上皮细胞培养液中加人过量胸苷,处于S期的细胞立刻被抑制,而处于其他时期的细胞不受影响。预计加人过量胸苷约 h后,细胞都将停留在S期。
(4)乙动物肠上皮细胞的细胞周期时长为24h,M期时长为l.9h。若要在显徽镜下观察细胞有丝分裂过程中染色体形态的变化,选用 (填“甲”或“乙”)动物肠上皮细胞更合适。
(5)在光学显徽镜下观察,同处于分裂末期的动物肠上皮细胞与洋葱根尖细胞,形态上最主要的区别是 。
29.(16分)硝酸是一种重要的化工原料,工业上生产硝酸的主要过程如下:
(1)以N2和H2为原料合成氨气。反应N2(g)+3H2(g)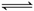 2NH3(g);△H<0
2NH3(g);△H<0
①下列措施可以提高H2的转化率是(填选项序号) 。
a.选择适当的催化剂 b.增大压强 c.及时分离生成的NH3 d.升高温度
②一定温度下,在密闭容器中充入1 mol N2和3 mol H2发生反应。若容器容积恒定,达到平衡状态时,气体的总物质的量是原来的,则N2的转化率a1= ;
若容器压强恒定,达到平衡状态时,N2的转化率为a2,则a2____a1(填“>”、“<”或“=”)。
(2)以氨气、空气为主要原料制硝酸。
①NH3被氧气催化氧化生成NO的反应的化学方程式是 。
②在容积恒定的密闭容器中进行反应2NO(g)+O2(g)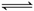 2NO2(g);△H>0
2NO2(g);△H>0
该反应的反应速率(v)随时间(t)变化的关系如右图所示。若t2、t4时刻只改变一个条件,下列说法正确的是(填选项序号) 。
a.在t1~t2时,可依据容器内气体的压强保持不变判断反应
已达到平衡状态
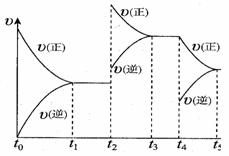 b.在t2时,采取的措施可以是升高温度
b.在t2时,采取的措施可以是升高温度
c.在t3-t4时,可依据容器内气体的密度保持不变判 断反应已达到平衡状态
d.在t5时,容器内NO2的体积分数是整个过程中的最大值
(3)硝酸厂常用如下两种方法处理尾气。
①催化还原法:催化剂存在时用H2将NO2还原为N2。
已知:2H2(g)+O2(g)=2H2O(g);△H=-483.6 kJ/mol
N2(g)+2O2(g)=2NO2(g);△H =+67.7 kJ/mol
则H2还原NO2生成水蒸气反应的热化学方程式是 。
②碱液吸收法:用Na2CO3溶液吸收NO2生成CO2。
若每9.2 g NO2和Na2CO3溶液反应时转移电子数为0.1 mol,则反应的离子方程是 。
28.(16分)A、B、C、D、E 5种短周期主族元素分占三个周期,A、B、C为同一周期依次相邻的3种元素,A和C的原子序数之比为3:4,E原子的电子层数等于最外层电子数,D的原子序数小于E。用化学用语回答相关问题:
(1)A元素在周期表中的位置 。
(2)比较C和E简单离子半径大小: 。
(3)元素E的一种常见的可溶性盐溶液呈碱性,其原因是(用离子方程式表示):
;
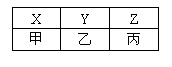 (4)X、Y、Z、甲、乙、丙是由A、B、C分别与D形成
(4)X、Y、Z、甲、乙、丙是由A、B、C分别与D形成
的化合物,六种化合物可以排成下表,其中同一横行的分
子中电子数相同,同一纵行的物质所含元素种类相同,其
中X、Y、甲常温常压下为气体, Z、乙、丙常温常压下为液体。
①甲的分子式为 ,丙的电子式为 。
②乙和丙常作火箭推进器的燃料,反应后的产物无污染。已知8g液态乙与足量液态丙完全反应,产物均为气体时放出热量为160.35 kJ,试写出 该反应的热化学方程式: 。
(5)2007年7月2日,美、德两国科学家成功合成了具有独特化学特性的E2D6化合物,写出它在C2中完全燃烧的化学方程式: 。
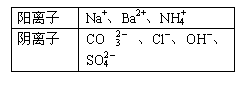
27.(14分)有A、B、C、D四种强电解质,它们
在水中电离可产生表中离子(每种物质只含一种
阴离子且互不重复)。已知:①A、C液体的pH
均大于7, A、B的溶液中水的电离程度比纯水大;②C溶液和D溶液相遇时只生成白色沉淀,B溶液和C溶液相遇时只生成刺激性气味的气体,A溶液和D溶液混合时无明显现象。
填写下列空白:
(1)A是 ,B是 ,C是 ,D是 。
(2)将等体积、等物质的量浓度的B溶液和C溶液混合,反应后溶液中各种离子浓度由大到小的顺序为 。
(3)常温下,0.15 mol•L-1 C溶液与0.20 mol•L-1 盐酸混合,所得混合液的pH=13,则C溶液与盐酸的体积比是 。
26.(14分)H2O2是在医疗、化工方面应用广泛的化学试剂。
(1)Na2O2、CaO2以及BaO2都可与酸作用生成过氧化氢,实验室通过上述某种过氧化物与适量稀硫酸作用,过滤后即可制得较纯净的H2O2溶液,则应选择的过氧化物是_______________;
(2)实验室可用H2O2与次氯酸钠反应制氧气, 其中还原剂是__________,生成0.5 mol氧气,转移电子____________mol,其反应的化学方程式为____________________________________;
(3)用酸性高锰酸钾溶液滴定法可测定双氧水中H2O2的含量,有两位同学分别用以下化学方程式表示其中的反应原理:
①5H2O2+2KMnO4+3H2SO4→2MnSO4+K2SO4+5O2↑+8H2O
②3H2O2+2KMnO4+3H2SO4→2MnSO4+K2SO4+4O2↑+6H2O
 你认为其中错误的是_______(认为没有可以不填),简述理由________________________。
你认为其中错误的是_______(认为没有可以不填),简述理由________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com