
15.甲乙两车同时从同一地点出发,甲先以a1加速t时间,再以a2加速t时间,位移s1;乙先以a2加速t时间,再以a1加速t时间,位移为s2。已知a1>a2,则有( )
A.s1可能大于s2; B.s1可能小于s2;
C. s1可能等于s2; D. s1一定大于s2;
14.一质点在某段时间内做曲线运动,则在这段时间内( )
A.速度一定在不断地改变,加速度也一定不断地改变
B.速度一定在不断地改变,加速度可以不变
C.速度可以不变,加速度一定不断地改变
D.速度可以不变,加速度也可以不变
29.(16分)硝酸是一种重要的化工原料,工业上生产硝酸的主要过程如下:
(1)以N2和H2为原料合成氨气。反应N2(g)+3H2(g) 2NH3(g);△H<0
2NH3(g);△H<0
①下列措施可以提高H2的转化率是(填选项序号) 。
a.选择适当的催化剂 b.增大压强 c.及时分离生成的NH3 d.升高温度
②一定温度下,在密闭容器中充入1 mol N2和3 mol H2发生反应。若容器容积恒定,达到平衡状态时,气体的总物质的量是原来的,则N2的转化率a1= ;
若容器压强恒定,达到平衡状态时,N2的转化率为a2,则a2____a1(填“>”、“<”或“=”)。
(2)以氨气、空气为主要原料制硝酸。
①NH3被氧气催化氧化生成NO的反应的化学方程式是 。
②在容积恒定的密闭容器中进行反应2NO(g)+O2(g) 2NO2(g);△H>0
2NO2(g);△H>0
该反应的反应速率(v)随时间(t)变化的关系如右图所示。若t2、t4时刻只改变一个条件,下列说法正确的是(填选项序号) 。
a.在t1~t2时,可依据容器内气体的压强保持不变判断反应
已达到平衡状态
 b.在t2时,采取的措施可以是升高温度
b.在t2时,采取的措施可以是升高温度
c.在t3-t4时,可依据容器内气体的密度保持不变判 断反应已达到平衡状态
d.在t5时,容器内NO2的体积分数是整个过程中的最大值
(3)硝酸厂常用如下两种方法处理尾气。
①催化还原法:催化剂存在时用H2将NO2还原为N2。
已知:2H2(g)+O2(g)=2H2O(g);△H=-483.6 kJ/mol
N2(g)+2O2(g)=2NO2(g);△H =+67.7 kJ/mol
则H2还原NO2生成水蒸气反应的热化学方程式是 。
②碱液吸收法:用Na2CO3溶液吸收NO2生成CO2。
若每9.2 g NO2和Na2CO3溶液反应时转移电子数为0.1 mol,则反应的离子方程是 。
28.(16分)A、B、C、D、E 5种短周期主族元素分占三个周期,A、B、C为同一周期依次相邻的3种元素,A和C的原子序数之比为3:4,E原子的电子层数等于最外层电子数,D的原子序数小于E。用化学用语回答相关问题:
(1)A元素在周期表中的位置 。
(2)比较C和E简单离子半径大小: 。
(3)元素E的一种常见的可溶性盐溶液呈碱性,其原因是(用离子方程式表示):
;
 (4)X、Y、Z、甲、乙、丙是由A、B、C分别与D形成
(4)X、Y、Z、甲、乙、丙是由A、B、C分别与D形成
的化合物,六种化合物可以排成下表,其中同一横行的分
子中电子数相同,同一纵行的物质所含元素种类相同,其
中X、Y、甲常温常压下为气体, Z、乙、丙常温常压下为液体。
①甲的分子式为 ,丙的电子式为 。
②乙和丙常作火箭推进器的燃料,反应后的产物无污染。已知8g液态乙与足量液态丙完全反应,产物均为气体时放出热量为160.35 kJ,试写出 该反应的热化学方程式: 。
(5)2007年7月2日,美、德两国科学家成功合成了具有独特化学特性的E2D6化合物,写出它在C2中完全燃烧的化学方程式: 。
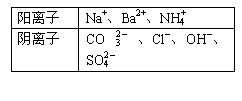
27.(14分)有A、B、C、D四种强电解质,它们
在水中电离可产生表中离子(每种物质只含一种
阴离子且互不重复)。已知:①A、C液体的pH
均大于7, A、B的溶液中水的电离程度比纯水大;②C溶液和D溶液相遇时只生成白色沉淀,B溶液和C溶液相遇时只生成刺激性气味的气体,A溶液和D溶液混合时无明显现象。
填写下列空白:
(1)A是 ,B是 ,C是 ,D是 。
(2)将等体积、等物质的量浓度的B溶液和C溶液混合,反应后溶液中各种离子浓度由大到小的顺序为 。
(3)常温下,0.15 mol•L-1 C溶液与0.20 mol•L-1 盐酸混合,所得混合液的pH=13,则C溶液与盐酸的体积比是 。
26.(14分)H2O2是在医疗、化工方面应用广泛的化学试剂。
(1)Na2O2、CaO2以及BaO2都可与酸作用生成过氧化氢,实验室通过上述某种过氧化物与适量稀硫酸作用,过滤后即可制得较纯净的H2O2溶液,则应选择的过氧化物是_______________;
(2)实验室可用H2O2与次氯酸钠反应制氧气, 其中还原剂是__________,生成0.5 mol氧气,转移电子____________mol,其反应的化学方程式为____________________________________;
(3)用酸性高锰酸钾溶液滴定法可测定双氧水中H2O2的含量,有两位同学分别用以下化学方程式表示其中的反应原理:
①5H2O2+2KMnO4+3H2SO4→2MnSO4+K2SO4+5O2↑+8H2O
②3H2O2+2KMnO4+3H2SO4→2MnSO4+K2SO4+4O2↑+6H2O
 你认为其中错误的是_______(认为没有可以不填),简述理由________________________。
你认为其中错误的是_______(认为没有可以不填),简述理由________________________。
13.有关①100 mL 0.1 mol/L NaHCO3 ②100 mL 0.1 mol/L Na2CO3两种溶液的叙述不正确的是( )
A.溶液中水电离出的H+个数:②>① B.溶液中阴离子的物质的量浓度之和:②>①
C.①溶液中: c(CO2-3 )>c(H2CO3) D.②溶液中: c(HCO-3)>c(H2CO3)
第Ⅱ卷(非选择题)
12.已知,Fe2+结合S2-的能力大于结合OH-的能力,而Al3+则正好相反。在Fe2(SO4)3和AlCl3的混合溶液中,先加入过量的KI溶液,再加入足量的Na2S溶液,所得沉淀是( )
A.Al2S3、FeS和S B.Fe(OH)3和Al(OH)3
C.Fe2S3和 Al(OH)3 D. FeS、Al(OH)3和S
11.比较氯元素和硫元素的非金属性的相对强弱,下列方案中不能达到目的的是( )
A.加热条件下,氯气和硫分别与铜反应,比较生成物中铜的化合价
B.比较氯化氢和硫化氢的热稳定性
C.往H2S溶液中通入氯气
D.分别测定0.1 mol/L氯化钠溶液和0.1 mol/L硫化钠溶液的pH
10.在高温和催化剂存在下,向容积为2 L的密闭容器加入0.2 mol CO和0.2 mol H2O,发生如下反应:CO(g)+H2O(g) CO2(g)+H2(g);∆H=-a kJ/mol(a>0)。达到平衡后,测得c(CO)∶c(CO2)=2∶3。下列说法正确的是( )
CO2(g)+H2(g);∆H=-a kJ/mol(a>0)。达到平衡后,测得c(CO)∶c(CO2)=2∶3。下列说法正确的是( )
A.反应放出的热量为0.2a kJ
B.平衡时H2O的转化率为60 %
C.升高温度,v(正) 加快v (逆) 减慢,平衡正向移动
D.将容器的体积压缩为1 L,H2的体积分数变为60 %
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com