
读水循环示意图,完成1-3题。
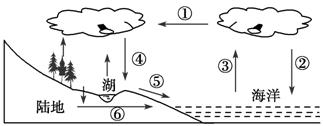
1.下列实现着图中①的功能的是( )
A.长江 B.副热带高气压带
C.我国的夏季风 D.我国的冬季风
2.在水循环的各个环节中,我国的南水北调工程体现人类活动对下列哪个环节施加了影响( )
A.① B.④
C.⑤ D.⑥
3.关于水循环深刻而广泛地影响着全球地理环境的原因,叙述正确的是( )
①它是地球上最活跃的能量交换过程之一,能缓解不同纬度热量收支不平衡的矛盾
②它是地球上最活跃的物质循环过程之一,是联系海陆之间的主要纽带
③它是自然界最富动力作用的循环运动,但它不能塑造地表形态
④它对地表太阳能可起到传输作用,但不能起吸收和转化的作用
A.①② B.③④
C.②④ D.①④
解析:第1题,根据水循环示意图①属水汽输送环节,我国的夏季风可以从海洋带来大量水汽。第2题,南水北调是改变地表水空间分布的工程措施。第3题,水循环是地球上最活跃的物质循环过程和能量交换过程。
答案:1.C 2.C 3.A
例1、将20mL0.4mol·L-1硝酸铵溶液跟50mL  0.1mol·L-1的氢氧化钡溶液混合,则混合溶液中离子浓度的大小顺序是( )
A.(NO3-)>c(OH-)>c(NH4+)>c(Ba2+)
B.c(NO3-)>c(Ba2+)>c(OH-)>c(NH4+)
C.c(Ba2+)>c(NO3-)>c((OH-)>c(NH4+)
D.c(NO3-)>c(Ba2+)>c(NH4+)>c(OH-)
0.1mol·L-1的氢氧化钡溶液混合,则混合溶液中离子浓度的大小顺序是( )
A.(NO3-)>c(OH-)>c(NH4+)>c(Ba2+)
B.c(NO3-)>c(Ba2+)>c(OH-)>c(NH4+)
C.c(Ba2+)>c(NO3-)>c((OH-)>c(NH4+)
D.c(NO3-)>c(Ba2+)>c(NH4+)>c(OH-)
 c(NO3-)>c(Ba2+)>c(OH-)>c(NH4+),B正确。
例2、在10mL 0.1mol·L-1NaOH溶液中加入同体积同浓度的CH3COOH溶液,反应同溶液中各粒子浓度关系错误的是( )
A.c(Na+)>c(CH3COO-)>c(H+)>c(OH-
c(NO3-)>c(Ba2+)>c(OH-)>c(NH4+),B正确。
例2、在10mL 0.1mol·L-1NaOH溶液中加入同体积同浓度的CH3COOH溶液,反应同溶液中各粒子浓度关系错误的是( )
A.c(Na+)>c(CH3COO-)>c(H+)>c(OH- )
B.c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
C.c(Na+)=c(CH3COO-)十c
)
B.c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
C.c(Na+)=c(CH3COO-)十c (CH2COOH)
D.c(Na+)十c(H+)=c(CH3COO-)十c(OH-)
解析:NaOH与CH3COOH恰好完全反应生成CH3COONa,由于CH3COO-的水解,显然c(Na+)
(CH2COOH)
D.c(Na+)十c(H+)=c(CH3COO-)十c(OH-)
解析:NaOH与CH3COOH恰好完全反应生成CH3COONa,由于CH3COO-的水解,显然c(Na+)
(二)定量离子方程式的书写 1、酸式盐与碱
例1、写出碳酸氢钠溶液分别与少量石灰水、过量石灰水反应的离子方程式。
解析:NaHCO3与少量Ca(OH)2反应时,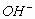 只抵消
只抵消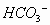 中的
中的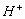 ,生成正盐
,生成正盐
Na2CO3和CaCO3,若Ca(OH)2过量,需考虑过量的Ca(OH)2能否与生成的Na2CO3和CaCO3继续反应,所以应为:
Ca(OH)2少量: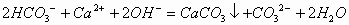 Ca(OH)2过量时:
Ca(OH)2过量时: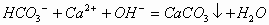 2、离子定量沉淀
例2、向明矾
2、离子定量沉淀
例2、向明矾 溶液中滴加Ba(OH)2溶液,使
溶液中滴加Ba(OH)2溶液,使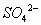 全部沉淀,写出离子反应方程式。
全部沉淀,写出离子反应方程式。
向明矾溶液中滴加Ba(OH)2溶液,使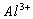 全部沉淀,写出离子反应方程式。
解析:使1mol KAl(SO4)2·12H2O中的2mol
全部沉淀,写出离子反应方程式。
解析:使1mol KAl(SO4)2·12H2O中的2mol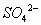 完全沉淀,需2mol Ba(OH)2,此时
完全沉淀,需2mol Ba(OH)2,此时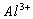 与
与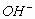 的物质的量之比为1:4,生成
的物质的量之比为1:4,生成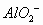 和H2O。故应为:
和H2O。故应为:
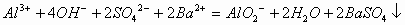
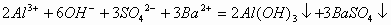 3、一种氧化剂与多种还原剂
3、一种氧化剂与多种还原剂
例3、在2mol/L
FeBr2溶液80mL中通入4.48L氯气(标准状况下),充分反应后,写出对应的离子方程式。
分析: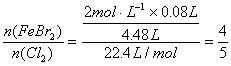 即可理解为4mol FeBr2与5mol
Cl2反应。因Cl2先氧化
即可理解为4mol FeBr2与5mol
Cl2反应。因Cl2先氧化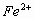 ,后氧化
,后氧化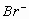 ,依电子得失守恒可知,5mol Cl2可得
,依电子得失守恒可知,5mol Cl2可得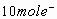 ,
,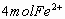 被氧化成
被氧化成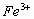 能失去
能失去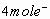 ,还差
,还差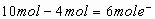 ,故
,故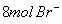
 只有6mol被氧化,还剩
只有6mol被氧化,还剩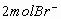 。则离子方程式可直接写为:
。则离子方程式可直接写为:
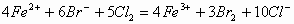 例4、能正确表示下列化学反应的离子方程式是( )
A.用碳酸钠溶液吸收少量二氧化硫:2CO32-十SO2十H2O=2HCO3-
例4、能正确表示下列化学反应的离子方程式是( )
A.用碳酸钠溶液吸收少量二氧化硫:2CO32-十SO2十H2O=2HCO3- 十SO32-
B.金属铝溶于盐酸中:Al十2H+=
十SO32-
B.金属铝溶于盐酸中:Al十2H+= Al3+十H2↑
C.硫化钠溶于水中:S2-十2H2O=H2S↑十2OH-
D.碳酸镁溶于硝酸中:CO32-十2H+=H2O十CO2↑
Al3+十H2↑
C.硫化钠溶于水中:S2-十2H2O=H2S↑十2OH-
D.碳酸镁溶于硝酸中:CO32-十2H+=H2O十CO2↑
 例5、下列离子方程式中正确的是(
)
A.过量的NaHSO4与Ba(OH)2溶液反应:Ba2+十2OH-十2H+十SO42-→BaSO4↓十2H2O
B.NH4HCO3溶液与过量NaOH溶液反应:NH4+十OH-→N
例5、下列离子方程式中正确的是(
)
A.过量的NaHSO4与Ba(OH)2溶液反应:Ba2+十2OH-十2H+十SO42-→BaSO4↓十2H2O
B.NH4HCO3溶液与过量NaOH溶液反应:NH4+十OH-→N H3↑十H2O
H3↑十H2O
C.苯酚钠溶液中通入少量CO2:
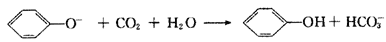 D.FeBr2溶液中通入少量Cl2:2Fe2+十2Br-十2Cl2→2Fe3+十Br2十4Cl-
D.FeBr2溶液中通入少量Cl2:2Fe2+十2Br-十2Cl2→2Fe3+十Br2十4Cl-

(一)滴加顺序与离子反应
在化学反应中相同的两种试剂,由于滴加顺序的不同会产生不同的现象,发生不同的离子反应。现归纳如下:
1、强碱溶液(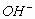 )与可溶性的铝盐溶液
)与可溶性的铝盐溶液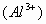 向
向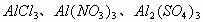 溶液中滴加NaOH或KOH溶液,或向
溶液中滴加NaOH或KOH溶液,或向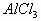 、
、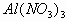 溶液中滴加
溶液中滴加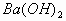 溶液,先出现白色沉淀,后沉淀消失。其离子反应方程式为:
溶液,先出现白色沉淀,后沉淀消失。其离子反应方程式为:
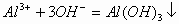
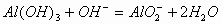 若反向滴加时,开始无明显现象,后出现白色沉淀。其离子反应方程式为:
若反向滴加时,开始无明显现象,后出现白色沉淀。其离子反应方程式为:
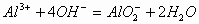
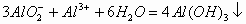 2、强酸溶液或强酸的酸式盐溶液
2、强酸溶液或强酸的酸式盐溶液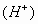 与偏铝酸盐溶液
与偏铝酸盐溶液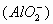 向
向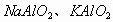 溶液中滴加HCl、H2SO4、HNO3、NaHSO4或KHSO4溶液,先出现白色沉淀,后沉淀消失。其离子反应方程式为:
溶液中滴加HCl、H2SO4、HNO3、NaHSO4或KHSO4溶液,先出现白色沉淀,后沉淀消失。其离子反应方程式为:
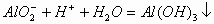
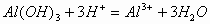 若反向滴加时,开始无明显现象,后出现白色沉淀。其离子反应方程式为:
若反向滴加时,开始无明显现象,后出现白色沉淀。其离子反应方程式为:
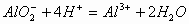
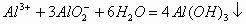 3、不稳定的多元弱酸盐溶液与强酸或强酸的酸式盐溶液
向
3、不稳定的多元弱酸盐溶液与强酸或强酸的酸式盐溶液
向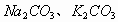 溶液中滴加HCl、H2SO4、HNO3、NaHSO4或KHSO4溶液,开始无明显现象,后有气体放出。其离子反应方程式为:
溶液中滴加HCl、H2SO4、HNO3、NaHSO4或KHSO4溶液,开始无明显现象,后有气体放出。其离子反应方程式为:
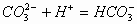
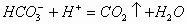 若反向滴加时,立即产生气体。其离子反应方程式为:
若反向滴加时,立即产生气体。其离子反应方程式为:
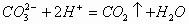 4、多元酸与强碱溶液反应生成的正盐和酸式盐的溶解性不同
向H3PO4溶液中滴加
4、多元酸与强碱溶液反应生成的正盐和酸式盐的溶解性不同
向H3PO4溶液中滴加 溶液,开始无明显现象,后产生白色沉淀。其离子反应方程式为:
溶液,开始无明显现象,后产生白色沉淀。其离子反应方程式为:
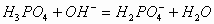
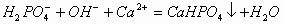
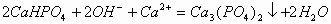 若反向滴加时,立即出现白色沉淀,后沉淀消失。其离子反应方程式为:
若反向滴加时,立即出现白色沉淀,后沉淀消失。其离子反应方程式为:
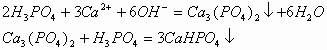
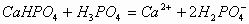 5、硝酸银溶液与氨水
向
5、硝酸银溶液与氨水
向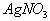 溶液中滴加氨水,先有沉淀产生,后沉淀又溶解。其离子反应方程式为:
溶液中滴加氨水,先有沉淀产生,后沉淀又溶解。其离子反应方程式为:
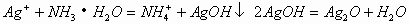
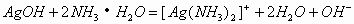 或
或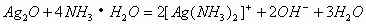 若反应滴加时,先无明显现象,后有沉淀生成。其离子反应方程式为:
若反应滴加时,先无明显现象,后有沉淀生成。其离子反应方程式为:
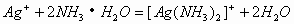
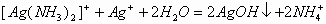
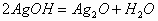 6.
6. 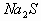 溶液与
溶液与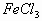 溶液
向
溶液
向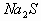 溶液中滴加
溶液中滴加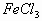 溶液,产生黑色沉淀,溶液变成无色。其离子反应方程式为:
溶液,产生黑色沉淀,溶液变成无色。其离子反应方程式为:
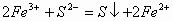
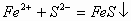 两反应相继进行。
若反向滴加时,先产生淡黄色沉淀,溶液变成浅绿色,后溶液中又出现黑色沉淀,溶液变成无色。其离子反应方程式为:
两反应相继进行。
若反向滴加时,先产生淡黄色沉淀,溶液变成浅绿色,后溶液中又出现黑色沉淀,溶液变成无色。其离子反应方程式为:
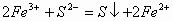 (先反应)
(先反应)
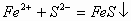 (后反应)
(后反应)
21.(本小题满分13分)已知函数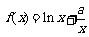 .
.
(1)当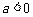 时,求函数
时,求函数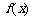 的单调区间;
的单调区间;
(2)若函数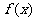 在
在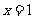 处的切线与直线
处的切线与直线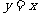 互相垂直,求该切线方程
互相垂直,求该切线方程
(3)若函数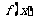 在
在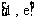 上的最小值是
上的最小值是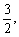 求
求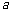 的值.
的值.
20.(本小题满分13分)已知函数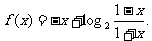
(1)求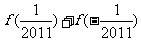 的值;
的值;
(2)当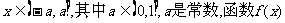 是否存在最小值?若存在,求出
是否存在最小值?若存在,求出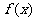 的最小值;若不存在,请说明理由。
的最小值;若不存在,请说明理由。
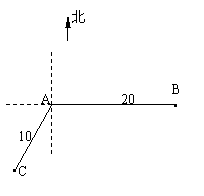
19.(本小题满分13分)
如图,当甲船位于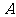 处时获悉,在其正东方向相距20海里的
处时获悉,在其正东方向相距20海里的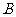 处有一艘渔船遇险等待营救.甲船立即前往救援,同时把消息告知在甲船的南偏西30
处有一艘渔船遇险等待营救.甲船立即前往救援,同时把消息告知在甲船的南偏西30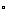 ,相距10海里
,相距10海里 处的乙船.
处的乙船.
(Ⅰ)求处于 处的乙船和遇险渔船间的距离;
处的乙船和遇险渔船间的距离;
 (Ⅱ)设乙船沿直线
(Ⅱ)设乙船沿直线 方向前往
方向前往 处救援,其方向与
处救援,其方向与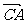 成
成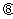 角,求
角,求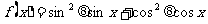
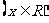 的值域。
的值域。
18. (本小题满分12分) 已知函数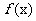
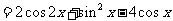 。
。
(Ⅰ)求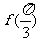 的值;
的值;
(Ⅱ)求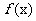 的最大值和最小值。
的最大值和最小值。
17. (本小题满分12分)已知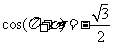 ,且
,且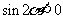
(1)求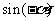 的值;
(2)求
的值;
(2)求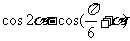 的值.
的值.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com