
1.加热分解法
[实例]:NaCl(NH4Cl) 、 Na2CO3(NaHCO3)
7.盐析
[原理与适用范围]:利用某些物质在加某些无机盐时,其溶解度降低而凝聚的性质来分离物质。
[实例]:皂化反应后,肥皂的提取;蛋白质的提纯。
6.渗析
[原理与适用范围]:
利用半透膜使胶体与混在其中的小分子、离子分离的方法。
[注意事项]:
渗析时要不断更换烧杯中的水或者改用流水,以提高渗析效果。
[实例]:淀粉一食盐的分离。
5.分液与萃取
(1)分液是把两种互不相溶的液体分开的方法。
[注意事项]:
①分液是在分液漏斗中进行的,使用前分液漏斗首先要检漏。
②分液时应将分液漏斗的塞子打开或塞子的小孔与瓶口的小孔对齐,使漏斗内部与大气相同,以利于液体流下;分液漏斗下端应靠着烧杯内壁。
③分液时:下层液体打开活塞于漏斗下口放出,上层液体则从上口倒出。
[实例]:水与苯的分离。
(2)萃取是利用溶质在互不相溶的溶剂里溶解度不同,用一种溶剂把溶质从另一种溶剂中提取出来的方法。
[注意事项]:
①萃取后要进行分液。得到的溶液一般要通过分馏的方法进一步分离。
②对萃取剂的要求:与原溶剂互不相溶、不反应;溶质在其中的溶解度不原溶剂大;溶质不与萃取剂反应;溶质与萃取剂易于分离。
③萃取过程中的注意点:将要萃取的溶液和萃取剂依次从上口倒入分液漏斗,其量不超过容积的2/3,塞好塞子振荡;振荡过程中有必要时可适当放气;振荡充分后将分液漏斗静置,待液体分层后分液。
[实例]:溴水中溴的提取。
4.蒸馏、分馏
[原理与适用范围]:利用沸点不同以分离互溶液体混合物
[装置与注意事项]:
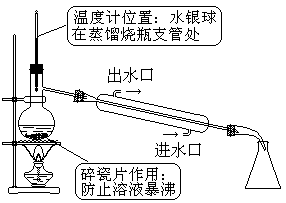
[实例]:苯与硝基苯的分离;工业酒精制无水乙醇等。
3.升华
[原理适用范围]:
混合物某一成分在一定温度下可直接变为气体,再冷却成固体。
[实例]:粗碘的提纯
2.蒸发、结晶与重结晶
(1)蒸发一般是用加热的方法,使溶剂不断挥发,从而使溶质析出的过程。
(2)结晶是溶质从溶液中析出晶体的过程。
[适用范围]:
结晶原理是根据混合物中各成分在某种溶剂里的溶解度不同,通过蒸发溶剂或降低温度使溶解度变小,从而使晶体析出。
[注意事项]:
①加热蒸发皿使溶液蒸发时,要用玻璃棒不断搅拌溶液,防止由于局部过热,造成液滴飞溅。当蒸发皿中出现较多量固体时,即停止加热。要求:溶质受热不易分解、不易水解、不易氧化。
②利用降温结晶时一般先配较高温度下的浓溶液,然后降温结晶,结晶后过滤,分离出晶体。
[实例]:KNO3与NaCl 分离
1.过滤
[装置与注意事项]:
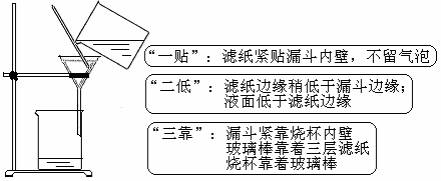
①过滤后得到的沉淀一般要洗涤。洗涤方法:沿玻璃棒向漏斗中注入少量水,使水面浸过沉淀物,等水滤出后,再次加水洗涤,连续几次,即可把固体洗涤干净。
②可取最后洗下的水加入适当的试剂检验沉淀是否洗净。
[适用范围]:用于固体与液体的分离
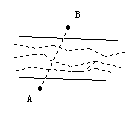
4. 如图,A、B两点是湖两岸上的两点,为测A、B两点距离,由于不能直接测量,请你设计一种方案,测出A、B两点的距离,并说明你的方案的可行性。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com