
4]材料科学是近年来与化学有关的科学研究的热点。某新型无机非金属材料K由两种非金属元素组成,它是一种超硬物质,具有耐磨、耐腐蚀、抗冷热冲击、抗氧化的特性,它是以中学化学中的常见物质为原料来生产的,下图所示为其生产过程,其中虚线框内转化是为探究C的组成而设,G、F、H均为难溶于水且为白色粉末;图中除M、K(均含A元素)外均为中学化学常见物质:
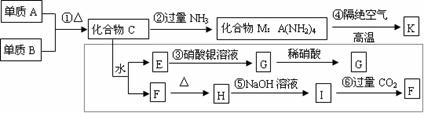
⑴写出化学式:单质B ,化合物F 。
⑵写出下列反应的离子反应方程式:
反应③ 反应⑤
⑶写出反应④的化学方程式
[命题解读]《考试说明》要求“了解金属材料、无机非金属材料、高分子合成材料、复合材料和其他新材料的特点,了解有关的生产原理”本题以“Si3N4”的生产过程为背景考查了学生的“接受、吸收、整合化学信息的能力,分析问题和解决问题的能力”。有关材料的问题往往科技知识联系密切,而且综合性较强,对学生的分析问题的能力要求较高。
[解题指导]从A(NH2)4可知A元素显+4价。而化合物C能够与水反应,生成的产物E能与硝酸银溶液反应生成G,且G不溶于硝酸,说明G是AgCl。这是做此题的关键。由此可得出化合物C中含有Cl 元素。再从F受热分解得F应为H4SiO4(或H2SiO3),进而可得出C中还应含有Si元素,从而可得出C为SiCl4。到此可推出图中的所有物质。
答案:(1)Cl2 H4SiO4(或H2SiO3)(2)Ag++Cl-=AgCl↓ SiO2+2OH-=SiCl4+H2O (4)3Si(NH)4 Si3N4+8NH3
Si3N4+8NH3
3]锌锰干电池广泛应用于日常生活、教学、科研和生产中。报废的干电池不回收利用,不仅是一个很大的资源浪费,而且如果处置不当,还可能造成严重的环境污染。废干电池是“放错了地方的资源”,是完全可以变废为宝的。酸性锌锰干电池的反应原理为:Zn+2NH4Cl=ZnCl2+2NH3↑+H2↑.废干电池的综合利用有多种方案,下面是其中的一种:
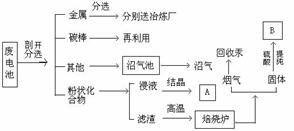
(1)电池底部的铁片通常采用的防腐措施是 ,回收时从金属混合物分选出铁的简单方法是
(2)回收时得到的产品A的主要成分是 ,将其分离的方法是
(3)干电池放电过程中产生的H2主要是与MnO2反应而被吸收,请你分析它们反应的原因和反应的类型,并推测其可能的产物
(4)在焙烧炉中隔绝空气高温焙烧的条件下,二氧化锰被还原成易溶液于酸的MnO或Mn,写出反应的化学方程式 、
(5)焙烧后的固体与硫酸作用时,其中一些重金属以可溶性硫酸盐存在于溶液中(重金属以可溶性硫酸盐用MeSO4来表示),通常用BaS与之反应生成难溶性的无毒硫化物和硫酸钡,其反应的离子方程式为
(6)回收得到的产品B是 ,在生产过程中一般需将其进一步转化为重要的化工原料MnCO3,请你用绿色化学的思想设计一个制备方案
[命题解读]《考试说明》提出“了解化学对废旧物资再生与综合利用的作用。”本题以废干电池的回收再利用为背景考查了学生“接受、吸收、整合化学信息的能力,分析问题和解决问题的能力,化学实验与探究能力”等三种能力。综合性较强,涉及到了基本操作、回收原理、综合应用等等多个方面。
[解题指导](1)这是一个常识性的问题,在干电池的底部就是镀锌铁皮。而对于铁的提取,最常用的物理方法就是磁选法。
(2)从干电池的放电原理来看(Zn+2NH4Cl=ZnCl2+2NH3↑+H2↑)最可能溶于水的两种物质就是NH4Cl和ZnCl2,从这两种盐的性质来看用加热法比较好。
(3)这是一个对能力要求较高的题目,从题目中可以看出MnO2与H2确实反应了,再从二者的性质上可以判断发生的是氧化还原反应。进而根据氧化还原反应原理可以对产物进行大胆的推测。
(4)本小题中有一个常识就是所得的滤渣中含有C这种物质,也是这个小题的隐含条件。一旦发现了这个隐含条件,这个小题就可迎刃而解了。
(5)这也是一个对能力要求较高的小题,也可看作是信息题。写离子方程式主要是看物质能不能拆,本题有两个判断①BaS要拆②MeSO4要拆。而对于其他几种物质很容易判断。
(6)这是一个现实性很强的问题。从题意可以看出,它的立足点是绿色化学。因此要防止新的污染的出现。因此本题中只要是涉及到用含钡我物质均不得分。而对于其他的把硫酸根离子转化为其他可利用的盐出可给分。
答案:(1)在铁表面镀锌 采用磁选法(2)NH4Cl和ZnCl2 将混合物加热,使NH4Cl分解气化,并冷却回收(3)氢气具有还原性,二氧化锰具有氧化性,二者发生氧化还原反应,氢气可被氧化生成水,二氧化锰被还原成低价的锰的化合物(4)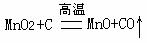
 (5)
(5)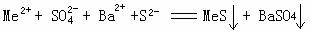 (6)MnSO4
(6)MnSO4
在硫酸锰溶液中加入适量的碳酸铵使之反应生成MnCO3,同时生成可作化肥的硫酸铵。(其他的合理答案也给分,关键是要注意绿色化学理念)
2]海水的综合利用可以制备金属镁,其流程如下图所示:
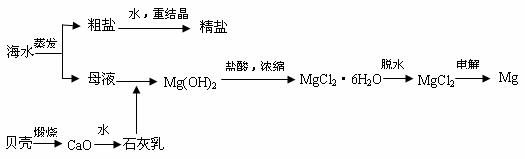
⑴若在空气中加热MgCl2·6H2O,生成的是Mg(OH)Cl或MgO,写出反应的化学方程式
用电解法制取金属镁时,需要无水氯化镁。在干燥的HCl气流中加热MgCl2·6H2O时,能得到无水MgCl2,其原因是
⑵Mg(OH)2沉淀中混有的Ca(OH)2应怎样除去?写出实验步骤。
⑶实验室里将粗盐制成精盐的过程中,在溶解、过滤、蒸发三个步骤中都要用到玻璃棒,分别说明在这三种情况下使用玻璃棒的目的。
溶解时 过滤时 蒸发时
[命题解读]《考试说明》指出“了解海水的综合利用”。本题是以“海水的综合利用可以制备金属镁,”为背景知识,考查了学生对课本所学知识有灵活应用能力,同时与实验结合起来,对一些实验中常见的基本操作进行了考查。
[解题指导]⑴MgCl2·6H2O在加热时可发生水解反应:MgCl2·6H2O  Mg(OH)Cl+HCl+5H2O,加热可促进水解,HCl、水蒸气的挥发使水解反应趋于完成,生成Mg(OH)Cl,Mg(OH)Cl受热进一步分解得到MgO;而在干燥的HCl气流中加热时,即可抑制MgCl2水解,又会带走MgCl2·6H2O受热产生的水蒸气,促进失去结晶水反应的发生,得到无水MgCl2。
Mg(OH)Cl+HCl+5H2O,加热可促进水解,HCl、水蒸气的挥发使水解反应趋于完成,生成Mg(OH)Cl,Mg(OH)Cl受热进一步分解得到MgO;而在干燥的HCl气流中加热时,即可抑制MgCl2水解,又会带走MgCl2·6H2O受热产生的水蒸气,促进失去结晶水反应的发生,得到无水MgCl2。
⑵由于Mg(OH)2难溶于水,而Ca(OH)2微溶于水,所以加入适量MgCl2溶液,过滤、洗涤、干燥可得纯净的Mg(OH)2。
⑶熟悉溶解、过滤、蒸发的操作要点,即可回答玻璃棒的作用。
答案:⑴MgCl2·6H2O  Mg(OH)Cl+HCl↑+5H2O↑
Mg(OH)Cl+HCl↑+5H2O↑

 MgCl2·6H2O MgO+2HCl↑+5H2O↑(Mg(OH)Cl MgO+HCl↑)
MgCl2·6H2O MgO+2HCl↑+5H2O↑(Mg(OH)Cl MgO+HCl↑)
在干燥的HCl气流中加热时,抑制了MgCl2水解,且带走MgCl2·6H2O受热产生的水蒸气,故得到无水MgCl2。
⑵加入MgCl2溶液,充分搅拌,过滤,沉淀用水洗涤
⑶搅拌,加速溶解 使待滤液体沿玻璃棒流入漏斗,防止溶液外洒 搅拌,防止因局部过热液滴或晶体飞溅
1]作为国家正在实施的“西气东输”工程终点站,上海将逐步改变以煤、石油气为主的能源结构,这对解决城市环境污染意义重大。目前上海大部分城市居民所使用的燃料主要是管道煤气,浦东新区开始使用东海天然气作为民用燃料,管道煤气的主要成分是CO、H2和少量烃类,天然气的主要成分是CH4,它们的燃烧反应如下:
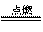
 2CO+O2
2CO+O2
 2CO2 2H2+O2 2H2O CH4+2O2 CO2+2H2O
2CO2 2H2+O2 2H2O CH4+2O2 CO2+2H2O
(1)根据以上化学方程式判断:燃烧相同体积的管道煤气和天然气,消耗空气体积较大的是 因此燃烧管道煤气的灶具如需改烧天然气,灶具的改进方法是 进风口(填“增大”或“减小”),如不作改进可能产生的不良结果是
|
|
乙烷 |
丙烷 |
丁烷 |
|
熔点/℃ |
-183.3 |
-189.7 |
-138.4 |
|
沸点/℃ |
-88.6 |
-42.1 |
-0.5 |
(2)管道煤气中含有的烃类,除甲烷外,还有
少量乙烷、 丙烷、丁烷等,它们的某些性质
见右表:
试根据以上某个关键数据解释冬天严寒季节有
管道煤气火焰很小,并且呈断续状态的原因是
[命题解读]“了解煤、石油和天然气等综合利用的意义。”是《考试说明》的要求之一。本题主要是以“西气东输”为背景材料,考查学生“接受、吸收、整合化学信息的能力”从三个化学方程式中获取有用的信息,然后再解决下面的问题。然后再与实际生活相结合,实现了新课标中提出的“注重测量自主学习的能力,重视理论联系实际”
[解题指导](1)从三个方程式可得出等物质的量的天然气消耗氧气的物质的量最大,即消耗空气的体积电大;进风口是用来提供氧气的,因为等物质的量的天然气比管道气消耗氧气多,所以要增大空气进口才能使天燃气燃烧充分;(2)从表中数据来看,当温度低于-0.50C时,丁烷即为液体,所以导致管道内气流不畅通。
答案:天然气 增大 不能充分燃烧,生成有毒的CO (2)丁烷遇冷凝结为液体使管道内气流不畅
3.化学与工农业生产
(1)了解化学在水处理中的应用。
(2)了解合成氨的主要原理、原料、重要设备、流程和意义,认识催化剂的研制对促进化学工业发展的重大意义。
(3)了解精细化工产品的生产特点、精细化工在社会发展中的作用。
(4)了解化学肥料、农药等在农业生产中的作用。
二 例题剖析及解答指导
2.化学与材料的制造、应用
(1)了解社会发展和科技进步对材料的要求。了解化学对材料科学发展的促进作用。
(2)了解金属材料、无机非金属材料、高分子合成材料、复合材料和其他新材料的特点,了解有关的生产原理。
(3)了解用化学方法进行金属材料表面处理的原理。
(4)了解我国现代材料研究和材料工业的发展情况。了解新材料的发展方向。
2.考察要点
1部分.化学与资源开发利用
(1)了解煤、石油和天然气等综合利用的意义。
(2)了解我国无机化工的生产资源和产品的主要种类。
(3)了解海水的综合利用。了解化学科学发展对自然资源利用的作用。
(4)了解化学对废旧物资再生与综合利用的作用。
1.考点阐释
化学与技术部分内容原来是穿插在了各个章节之中,并没有明确的考查要点,与各章节的内容合在一起进行考查。新课标中开设了化学与技术模块,主要分成了三大部分,①化学与资源开发利用。这一部分内容主要涉及到了煤、石油和天然气三种主要能源的开发与利用、海水的综合利用、废旧物资再生与综合利用三部分内容。②化学与材料的制造、应用。化学材料在原大纲中也有所体现,但不是很系统。在化学与技术模块中主要考查金属材料、无机非金属材料、高分子合成材料、复合材料和其他新材料的特点。③化学与工农业生产。这一部分内容在原大纲中不作要求,而在新课标中主要有水的处理、对合成氨的理解、肥料、农药等在农业生产中的作用。
化学与技术的内容与生产生活联系非常密切,在原来的高考题中往往以信息题的形式出现,题意往往比较新颖,考查的知识点比较综合,涉及到的知识点比较多,对学生的能力要求相对较高。
因为化学与技术只是一个选修模块,在高考中出题的形式是以填空或文字叙述的形式出现,而且只有一个题,所以试题的综合性较强,但难度不会很大,主要考查学生的“接受、吸收、整合化学信息的能力,分析问题和解决问题的能力,化学实验与探究能力”等三种能力,重点体现出新课程改革对于化学科的考核目标要求:“以能力测试为主导”,“注重测量自主学习的能力,重视理论联系实际”。
|
有机物 |
检验试剂 |
现象 |
化学方程式及理由 |
|
不饱和烃 |
|
|
|
|
甲苯(苯的同系物) |
|
|
|
|
苯酚 |
(1) (2) |
|
|
|
醛基物质 |
(1) (2) |
|
|
|
淀粉 |
|
|
|
|
蛋白质 |
|
|
|
[例1]一瓶澄清透明的溶液,可能含有下列离子中的一种或几种: 、
、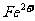 、
、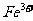 、
、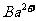 、
、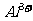 、
、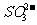 、
、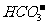 、
、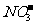 、
、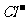 取溶液进行如下实验:
取溶液进行如下实验:
(1)溶液滴在蓝色石蕊试纸上,试纸呈红色。
(2)取少量溶液浓缩后加入铜片和浓硫酸共热,有红棕色气体生成。
(3)取少量溶液,加入用硝酸酸化的氯化钡溶液,产生白色沉淀。
(4)另将(3)中的沉淀过滤出,滤液中加入硝酸银溶液,生成白色沉淀
(5)另取原溶液,逐滴加入氢氧化钠溶液至过量,先看到生成沉淀,随之该沉淀部分溶解,并呈红褐色。
根据上述实验现象推断:
① 溶液中肯定存在的离子有 。
② 溶液中肯定不存在的离子有 。
③ 溶液中不能确定是否存在的离子有 。
[例2] 已知乙醇可以和氯化钙反应生成微溶于水的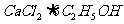 ,有关的有机试剂的沸点如下:
,有关的有机试剂的沸点如下:
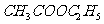 77.1℃;
77.1℃; 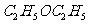 (乙醚)34.5℃;
(乙醚)34.5℃;
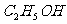 78.3℃;
78.3℃; 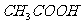 118℃
118℃
实验室合成乙酸乙酯粗产品的步骤如下:
在蒸馏烧瓶内将过量的乙醇与少量浓硫酸混合,然后经分液漏斗边滴加醋酸、边加热蒸馏,得到含有乙醇、乙醚、醋酸和水的乙酸乙酯粗产品。
(1)反应中加入的乙醇是过量的,其目的是:
(2)边滴加醋酸、边加热蒸馏的目的是:
将粗产品再经下列步骤精制:
(3)为除去其中的醋酸,可向产品中加入(填字母) 。
A. 无水乙醇 B. 碳酸钠粉末 C. 无水醋酸钠
(4)再向其中加入饱和氯化钙溶液,振荡,分离,其目的是:
(5)然后再向其中加入无水硫酸钠,振荡,其目的是:
最后,将经过上述处理后的液体放入另一干燥的蒸馏烧瓶内,再蒸馏。弃去低沸点馏分,收集沸程76℃-78℃之间的镏分即得。
|
阳离子 |
检验试剂 |
现象 |
化学方程式及理由 |
|
H+ |
|
|
|
|
NH4+ |
|
|
|
|
Na+ |
|
|
|
|
K+ |
|
|
|
|
Ba2+ |
|
|
|
|
Al3+ |
|
|
|
|
Ca2+ |
|
|
|
|
Fe3+ |
|
|
|
|
Fe2+ |
|
|
|
2.阴离子的检验
|
阴离子 |
检验试剂 |
现象 |
化学方程式及理由 |
|
Cl- |
|
|
|
|
Br- |
(1) (2) |
|
|
|
I- |
(1) (2) |
|
|
|
OH- |
(1) (2) (3) |
|
|
|
SO32- |
(1) (2) |
|
|
|
SO42- |
(1) (2) |
|
|
|
CO32- |
(1) (2) |
|
|
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com