
0.010+2x)2·x=1.1×10-12 ∵ x很小,∴ 0.010+2x≈0.010
x=1.1×10-8(mol·L-1) ∴ c(Ag2CrO4)=1.1×10-8 (mol·L-1)
∴ c(AgCl)>c(Ag2CrO4)
¤感悟高考真题
1答案:C
2、B
¤知识动脉
例1、A
变式训练1、答案:(1)①2SO2+O2+2CaCO3+4H2O=2(CaSO4·H2O)+2CO2或
2SO2+O2+2CaCO3+4H2O=2(CaSO4·H2O)+2CO2
②2SO2+O2+2Ca(OH)2+2H2O=2(CaSO4·2H2O)或2SO2+O2+2Ca(OH)2=2CaSO4+2H2O
(2) Ca(OH)2微溶于水,石灰水中Ca(OH)2浓度小,不利于吸收SO2
例2、(1)BaS+CuO+9H2O=Ba(OH)2·8H2O+CuS[也可写Ba(OH)2]
(2)CuS的溶度积比CuO小得多(更难溶),有利于该反应正向进行。
(3)CuS为难溶物(未反应的CuO也不溶),过滤后,将滤液浓缩、冷却,就可在溶液中析出Ba(OH)2·8H2O晶体,故生产效率高;CuS在空气中焙烧氧化可得CuO与SO2,故CuO可反复使用(SO2可用于制硫的化合物),因而成本低
变式训练2、H++OH-=H2O,使平衡向脱矿方向移动 5Ca2++3PO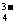 +F-=Ca5(PO4)3F↓ 加Ca2+(或加PO
+F-=Ca5(PO4)3F↓ 加Ca2+(或加PO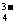 等)
等)
例3、①AgCl(s) Ag+(aq)+Cl-(aq)
Ag+(aq)+Cl-(aq)

Ag2CrO4(s)  2Ag+(aq)+CrO42-(aq)
2Ag+(aq)+CrO42-(aq)
2x x
(2x)2·x=Ksp
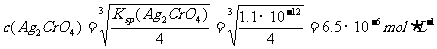
∴ c(AgCl)<c(Ag2CrO4)
②在0.010 mol·L-1 AgNO3溶液中,c(Ag+)=0.010 mol·L-1
AgCl(s)  Ag+(aq) + Cl-(aq)
Ag+(aq) + Cl-(aq)
溶解平衡时: 0.010+x x
1、BC
31. 在0.5 mol·1-1MgCl2溶液中加入等体积的0.1 mol·1-1氨水,是否产生Mg(OH)2沉淀?

¤课前小练:
30.已知Ksp[Ca(OH)2] = 5.5×10-6 mol3·L-3,则其饱和溶液的pH值是 
29.在CaCO3沉淀中加入HAc溶液,有 现象,其离子反应式是 。沉淀溶解的原因是 。在PbI2沉淀中,加入Na2S溶液后,现象为 其离子反应式是 。沉淀溶解的原因是 。
28.某混合溶液中KBr、KCl、KI的浓度均为0.01mol·L-1,向该溶液中逐滴加入0.01mol·L-1AgNO3溶液,先后产生沉淀的离子次序为 ,其沉淀物的颜色分别为 。
27.在Pb(NO3)2溶液中加入NaI溶液,有 现象产生,其离子反应式为 ;若在上层清夜中再加入KI溶液又有 现象产生,其离子反应式是 。说明
26.已知难溶于水的盐在水中存在溶解平衡,例如氯化银在水中的溶解平衡为:
AgCl(s) 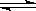 Ag+(aq) + Cl-(aq)
Ag+(aq) + Cl-(aq)
在一定温度下,水溶液中银离子(Ag+)和氯离子(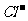 )的物质的量浓度的乘积为一常数,可用Ksp表示:Ksp
= [Ag+]·[
)的物质的量浓度的乘积为一常数,可用Ksp表示:Ksp
= [Ag+]·[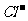 ] =
1.8 × 10-10
mol2·L-2
] =
1.8 × 10-10
mol2·L-2
现把氯化银(足量)分别放人:①100mL蒸馏水中;②100mL 0.1mol·L-1的盐酸溶液中;③1000mL 0.1 mol·L-l的氯化铝溶液中;④100mL0.1 mol·L-1的氯化镁溶液中。充分搅拌后,相同温度下,银离子浓度由大到小的顺序是(用序号回答) 。在0.1mol·L-l氯化铝溶液中,银离子的物质的量浓度最大可达到 mol·L-1。
25.对水垢的主要成分是CaC03和Mg(OH)2而不是CaC03和MgC03的原因解释,其中正确的有
A.Mg(OH)2的溶度积大于MgC03的溶度积,且在水中发生了沉淀转化
B.Mg(OH)2的溶度积小于MgC03的溶度积,且在水中发生了沉淀转化
C.MgCO3电离出的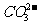 -发生水解,使水中
-发生水解,使水中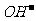 -浓度减小,对Mg(OH)2的沉淀溶解平衡而言,Qc<Ksp,生成Mg(OH)2沉淀
-浓度减小,对Mg(OH)2的沉淀溶解平衡而言,Qc<Ksp,生成Mg(OH)2沉淀
D.MgCO3电离出的CO32-发生水解,使水中OH-浓度增大,对Mg(OH)2的沉淀溶解平衡而言,Qc> Ksp,生成Mg(OH)2沉淀
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com