
向20ml某物质的量浓度的AlCl3溶液中滴加2mol/L NaOH溶液时,逐滴加入NaOH溶液直至过量。经测定,加入的NaOH溶液的体积(ml)和所得沉淀的物质的量(mol)的关系如下图所示。则:
 (1)写出代表各线段发生反应的离子方程式:
(1)写出代表各线段发生反应的离子方程式:
OA段 ,
AB段 ,
图中线段OP∶PB= 。
(2)计算原AlCl3溶液的物质的量浓度为 。
(3)图中A对应的横坐标为 ml
(4)当加入5ml NaOH溶液时,产生沉淀量为 mol。
(5)当加入的NaOH溶液过量时,使最初生成的沉淀部分溶解,要得到与(4)中相同的沉淀量,加入NaOH溶液的体积为 。
(相对原子质量:Na:23 C:12 H:1 O:16 Al:27)
21.(9分)有Na2CO3 和NaHCO3组成的混合物75g,放入坩埚中充分加热至质量不再减少为止,冷却称量剩下的固体质量为56.4g,计算这种混合物里的Na2CO3的质量分数是多少?
20.(14分)已知:NaAlO2+HCl+H2O=Al(OH) 3↓+NaCl
某混合物A,含有Al2(SO4)3、Al2O3和Fe2O3,在一定条件下可实现下图所示的物质之间的变化:
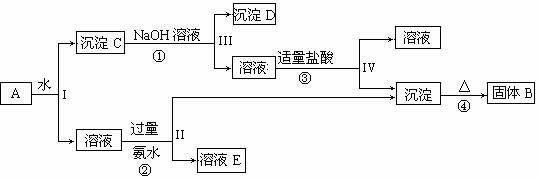
据此回答下列问题:
(1)I、II、III、IV四步中对于溶液和沉淀的分离采取的方法是 。
(2)根据上述框图反应关系,写出下列B、D、E所含物质的化学式
固体B ; 沉淀D ;
溶液E 。
(3)写出①、②、④三个反应方程式
① ;
② ;
④ 。
19.(9分)向一金属铝的易拉罐内充满CO2,然后向罐内注入足量NaOH溶液,立即用胶布严封罐口,过一段时间后,罐壁内凹而瘪,再过一段时间后,瘪了的罐壁重新鼓起,解释上述变化的实验现象:
(1)罐壁内凹而瘪的原因:
(2)罐壁重新鼓起的原因:
“重新鼓起”反应的离子方程式: 。
18.(8分)(1)Na2CO3固体中混有少量的NaHCO3固体,除去的方法是 ,
有关反应的化学方程式: 。
(2)除去铁粉中混有的少量铝粉,可选用试剂: 。
(3)除去FeCl2溶液中少量的FeCl3,可选用试剂 。
17.(4分)由地壳中含量最高的金属元素和非金属组成的化合物的名称是 ,铁红常用于制造红色油漆和涂料,它的化学式是 。
16.下列关于焰色反应的表示确切的是( )
A.焰色反应是元素的性质 B.可以用干净的铜丝代替铂丝
C.做完一种物质的实验后一定要用蒸馏水清洗铂丝才能继续做其它物质
D.Na2CO3焰色反应的颜色为黄色,透过蓝色钴玻璃观察到K2CO3焰色反应的颜色为紫色
15.将Na2O2投入FeCl3溶液中, 生成物有( )
A.Fe(OH)2 B.Fe(OH)3 C.H2 D.O2
14.金属钠投入水中会熔化成闪亮的小球,原因是( )
A.钠是银白色的金属 B.钠与水反应放出的热使钠熔化
C.金属钠的熔点低 D.钠与水反应产生的氢气使钠熔化
13.下列离子方程式正确的是 ( )
A.铁跟FeCl3溶液反应:Fe+Fe3+=2Fe2+
B.Fe跟稀盐酸反应:2Fe+6H+=2Fe3++3H2↑
C.FeCl2溶液跟Cl2反应:Fe2++Cl2=Fe3++2Cl-
D.Fe(OH)3跟盐酸反应:Fe(OH)3+3H+=Fe3++3H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com