
14、(2010·双鸭山模拟)X、Y、Z、W四种化合物均由短周期元素组成,其中X含有四种元素,X、Y、Z的焰色反应均为黄色,W为无色无味气体。这四种化合物具有下列转化关系(部分反应物、产物及反应条件已略去)。


请回答
(1)W是由 键构成的 分子(极性或非极性)
(2)X与Y在溶液中反应的离子方程式是 。
(3)利用下图装置(夹持固定装置已略去)进行实验,在装置I中加入X,装置II中加入一种淡黄色固体物质进行反应,装置III中生成白色沉淀,装置V中可收集到一种无色气体。
①装置II中反应的化学方程式是 。
检验装置V中物质的方法是 。
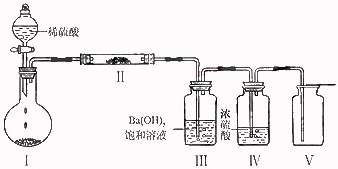
②用X含有的四种元素中的两种组成的某化合物,在催化剂存在下制备并收集纯净干燥的位置V中气体,所需仪器装置是 (从上图选择必要装置,填写编号)。反应的化学方程式是
[解析]X、Y、Z焰色反应为黄色,说明含Na元素;X含4中元素,加热能发生反应,且与稀硫酸反应能产生可与淡黄色固体(Na2O2)反应的气体,所以X为NaHCO3,装置III中生成的白色沉淀为BaCO3,V中收集到得无色气体为O2;NaHCO3分解得到Z,所以Z为NaCO3;Y为NaOH,W为CO2;检验氧气一般用带火星的木条。催化剂条件下制取氧气的含X中的两种元素的化合物是H2O2。
[答案](1)极性 非极性
(2)OH-+HCO3-= CO32-+H2O
(3)①2CO2+2Na2O2=2Na2CO3+O2
取一根带火星的木条,伸入集气瓶内,木条复燃
②Ⅰ,Ⅳ,Ⅴ 2H2O2= 2H2O+ O2↑
0.5LBa(OH)2溶液中含OH-:0.112×0.5×2 = 0.112 (mol)
OH-过量:0.112-0.012 = 0.1 (mol)
c(OH-) = 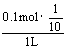 =0.01 mol/L c(H+) =10-12
mol/L pH=12
=0.01 mol/L c(H+) =10-12
mol/L pH=12
[答案](1)5.516 (2)0.112 mol/L
(3)5:2 (4)12
13、(2010·宜春模拟)为了测定K2CO3和NaHCO3混合物的组成,某学生每次称取一定质量的混合物溶于水配成溶液,向其中加入相同浓度的Ba(OH)2溶液,每次实验均充分反应,实验结果记录如下表:
|
实验次数 |
混合物的质量/g |
所加Ba(OH)2溶液的体积/L |
测得沉淀的质量/g |
|
1 |
1.716 |
0.5 |
2.758 |
|
2 |
3.432 |
0.5 |
|
|
3 |
5.148 |
0.5 |
8.274 |
|
4 |
6.864 |
0.5 |
11.032 |
|
5 |
8.580 |
0.5 |
11.032 |
|
6 |
10.296 |
0.5 |
11.032 |
请回答下列问题:
(1)第二次实验中产生沉淀的质量是 g;
(2)求所用Ba(OH)2的溶液的物质的量浓度__________ g·mol-1;
(3)求混合物中K2CO3和NaHCO3的物质的量之比 ;
(4)在25℃时,取下第3组实验所得溶液体积的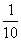 ,加水配成1000mL溶液,求此溶液pH=_____
,加水配成1000mL溶液,求此溶液pH=_____
[解析](1)第2次、第3次混合物的质量分别是第一次的2倍和3倍,而所得沉淀的质量第3次为第一次的3倍,由此判断,第二次Ba(OH)2过量,所以第二次所得沉淀质量应该是第一次的2倍,即5.516g
(2)因为第4、5、6组沉淀都是11.032g,故以第4组数据计算。
则:Ba(OH)2 - Ba2+ - BaCO3
c[Ba(OH)2]=(11.032/197)÷0.5=0.112 (mol/L)
(3)以第一组数据计算,设样品混合物中NaHCO3和K2CO3的物质的量分别为x和y。
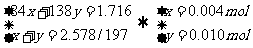
即n(K2CO3):n(NaHCO3) = 0.010:0.004= 5:2
(4)设第3次实验中固体混合物中含NaHCO3 x′mol,则含K2CO3 2.5 x′mol
84x′+ 138×2.5 x′= 5.148 x′= 0.012 mol
12、(2010·泰州模拟)下列物质的保存方法正确的是( )
①少量金属钠保存在冷水中
②浓硝酸盛放在棕色试剂瓶中
③少量金属钾保存在煤油中
④氢氧化钠溶液盛放在带有橡胶塞的试剂瓶中
⑤碳酸钠固体保存在带橡胶塞的细口瓶中
A.③④ B.①③④ C.②③④ D.③④⑤
[答案]C
11、(2010·石家庄模拟)将3.72g由金属钠、氧化钠和过氧化钠组成的混合物与足量水反应,在标准状况下得到672mL混合气体。将该混合气体用电火花点燃,恰好完全反应,则原混合物中钠、氧化钠、过氧化钠的物质的量之比为( )
A.3:2:1 B.4:2:1 C.1:1:l D.2:l:l
[答案]D
10、(2010·遵义模拟)碳酸钠俗称纯碱,下列对其性质的描述中,正确且能与“碱”相关的是( )
A、能与盐酸反应产生气体 B、能促进水的电离
C、水溶液能使紫色石蕊试纸变红色 D、水溶液能使酚酞呈红色
[解析]选D。A项,与酸反应产生气体,不属于碱的性质;B项,碱能抑制水的电离;C项,碱性溶液能使紫色石蕊试液变蓝
9、(2010·苏州模拟)用等质量的金属钠进行下列实验,产生氢气最多的是( )
A、将钠放入足量的稀盐酸中
B、将钠放入足量的稀硫酸中
C、将钠放入足量的氯化钠溶液中
D、将钠用铝箔包好,并刺一些小孔,放入足量的水中
[解析]选D。钠与水反应产生H2,且生成的NaOH又可以与Al反应产生H2,所以D项产生H2最多。
8、(2010·合肥模拟)在一密闭容器中有甲醛、氧气、氢气共16.5g,用电火花引燃,使其燃烧,再将燃烧后的气体用Na2O2充分吸收,Na2O2增重8.5g,则原混合气体中O2的物质的量是( )
A.0.25 mol B.0.50mol C.0.27 mol D.0.52 mol
[解析]选A。A项,通式符合(CO)m( H2)n的物质,燃烧后的气体被Na2O2吸收后,Na2O2增重的质量即为该物质的质量,甲醛、氢气都符合这一通式,甲醛与氢气的质量之和为8.5g,氧气质量为16.5g-8.5g=8g,其物质的量为0.25 mol。
7、(2010·北京丰台区模拟)下列说法正确的是( )
A.Na2O2与水反应,红热的Fe与水蒸气反应均能生成碱
B.Na和Cs属于第IA族元素,Cs失电子能力比Na强
C.NaHCO3、Na2CO3、(NH4)2CO3三种固体受热后均能生成气体
D.镁条在空气中燃烧生成的氧化物是MgO,钠在空气中燃烧生成的氧化物是Na2O
[解析]选B。A项,Fe与水蒸气反应生成Fe3O 4 ,B项,Cs的电子层数比Na多,更易失电子。C项,Na2CO3受热不分解;D项,钠在空气中燃烧生成的氧化物是Na2O2。
6、(2010·北京东城区模拟)仅通过物理方法就能从海水中获得的物质是 ( )
A.钠、镁 B.溴、碘 C.食盐、淡水 D.氯气、烧碱
[解析]选C。海水蒸馏可得淡水,蒸发海水可以得到食盐。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com