
12. 一定体积的KMnO4溶液恰好能氧化一定质量的KHC2O4·H2C2O4·2H2O。若用0.1000mol·L-1的NaOH溶液中和相同质量的KHC2O4·H2C2O4·2H2O,所需NaOH溶液的体积恰好为KMnO4溶液的3倍,则KMnO4溶液的浓度(mol·L-1)为
提示:①H2C2O4是二元弱酸
②10KHC2O4·H2C2O4+8KMnO4+17H2SO4=8MnSO4+9K2SO4+40CO2↑+32H2O
A.0.008889 B.0.08000 C.0.1200 D.0.2400
[答案]B
[解析]此题类型属于信息给予题,据题意并结合提示,H2C2O4为二元弱酸,可写出氢氧化钠与KHC2O4·H2C2O4·2H2O反应的方程式:
6NaOH+2KHC2O4·H2C2O4·2H2O=3Na2C2O4+K2C2O4+8H2O;
10[KHC2O4·H2C2O4]+8KMnO4+ 17H2SO4=8MnSO4+9K2SO4+40CO2+32H2O 。可得关系式:6NaOH~2KHC2O4·H2C2O4·2H2O,10[KHC2O4·H2C2O4]~8KMnO4 ;综合以上两式可得:15NaOH ~ 4KMnO4 , 结合题意:V(NaOH)=3V(KMnO4)可得出关系:
15NaOH ~ 4KMnO4
15 4
3V(KMnO4)×0.1000mol·L-1 V(KMnO4)×c(KMnO4)
列式得:15×V(KMnO4)×c(KMnO4)=4×3V(KMnO4)×0.1000mol·L-1,整理得:0.08000mol·L-1,答案选B。
[考点分析]氧化还原反应的滴定
11. 2 g Cu2S和CuS的混合物在酸性溶液中用400 mL 0.075 mol·L-1 KMnO4溶液处理,发生反应如下:
8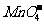 +5Cu2S+44H+====10Cu2++5SO2+8Mn2++22H2O
+5Cu2S+44H+====10Cu2++5SO2+8Mn2++22H2O
6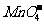 +5CuS+28H+====5Cu2++5SO2+6Mn2++14H2O
+5CuS+28H+====5Cu2++5SO2+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与350 mL 0.1 mol·L-1(NH4)2Fe(SO4)2溶液完全反应。
(1)配平KMnO4与(NH4)2Fe(SO4)2反应的离子方程式:

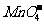 +
+ Fe2++
Fe2++ H+
H+ Mn2++
Mn2++ Fe3++
Fe3++ H2O
H2O
(2)KMnO4溶液与混合物反应后,剩余KMnO4的物质的量为_________mol。
(3)欲配制500 mL 0.1 mol·L-1 Fe2+溶液,需称取(NH4)2Fe(SO4)2·6H2O(M=392 g·mol-1)的质量为_________ g。
(4)混合物中Cu2S的质量分数为_________。
[答案](1)1 5 8 1 5 4 (2)0.007 (3)19.6 (4)40%
[解析]根据配平后的离子方程式,KMnO4-5(NH4)2Fe(SO4)2,则剩余KMnO4的物质的量为: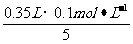 =0.07 mol。
=0.07 mol。
需称量固体的质量为:0.5 L×0.1 mol·L-1×392 g·mol-1=19.6 g21世纪教育网
假设混合物中Cu2S的物质的量为x,CuS的物质的量为y,结合以上数据列出方程组:
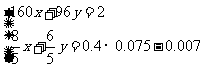 ,解得结果
,解得结果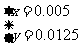 ,则混合物中Cu2S的质量分数为:
,则混合物中Cu2S的质量分数为: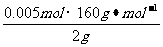 ×100%=40%。
×100%=40%。
[考点分析]氧化还原反应的配平及综合计算
10. a mol FeS与b mol FeO投入到V L、c mol·L-1的硝酸溶液中充分反应,产生NO气体,所得澄清溶液成分可看作是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为( )
①(a+b)×63 g
②(a+b)×189 g ③(a+b)mol ④(Vc-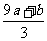 )mol
)mol
A.①④ B.②③
C.①③ D.②④
[答案]D
[解析]由元素守恒知:未被还原的硝酸将转化为Fe(NO3)3中的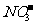 ,所以显酸性的硝酸的物质的量等于Fe(NO3)3的物质的量的3倍,由元素守恒知,n(Fe(NO3)3)=n(Fe)=(a+b) mol,所以未被还原的硝酸的质量=3 (a+b) mol×63 g·mol-1=(a+b)×189 g,②正确;又根据化合价升降守恒知
,所以显酸性的硝酸的物质的量等于Fe(NO3)3的物质的量的3倍,由元素守恒知,n(Fe(NO3)3)=n(Fe)=(a+b) mol,所以未被还原的硝酸的质量=3 (a+b) mol×63 g·mol-1=(a+b)×189 g,②正确;又根据化合价升降守恒知
a mol 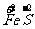 →a mol
→a mol 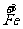 (NO3)3+a mol
(NO3)3+a mol 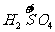 升高(3-2)a+(6+2)a=9a mol
升高(3-2)a+(6+2)a=9a mol
b mol 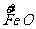 →b mol
→b mol 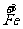 (NO3)3 升高(3-2)b=b mol
(NO3)3 升高(3-2)b=b mol
x mol H 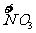 →x mol
→x mol 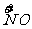 降低(5-2)x
mol=3x mol
降低(5-2)x
mol=3x mol
得9a mol+b mol=3x mol,即显氧化性的硝酸的物质的量x=(9a+b)/3 mol,所以未被还原的硝酸为(Vc- )mol,④正确21世纪教育网
)mol,④正确21世纪教育网
[考点分析]本题以元素化合物知识为载体,考查守恒法技巧。
9. 一个完整的氧化还原反应方程式可以拆开,写成两个“半反应式”,一个是“氧化反应式”,一个是“还原反应式”。如2Fe3++Cu===2Fe2++Cu2+,可拆写为氧化反应式:Cu-2e-===Cu2+,还原反应式:2Fe3++2e-=== 2Fe2+。据此,回答下列问题:
⑴将反应Zn+2H+ === Zn2++H2↑拆写为两个“半反应式”:
氧化反应式: ,还原反应式: 。
⑵将反应3NO2+H2O == 2H++2NO3-+NO拆写为两个“半反应式”:
氧化反应式: ,还原反应式: 。
⑶已知某反应的两个“半反应式”为:CH4+10 OH--8e-===CO32-+7H2O,O2+2H2O+4e-=== 4OH-,则氧化还原反应方程式为 。
[答案]⑴Zn-2e-=== Zn2+,2 H++2e-=== H2 。
⑵2NO2+2H2O-2e-=== 4H++2 NO3-;NO2+2 H++2e-=== NO+H2O
⑶CH4+2O2+2OH-=== CO32-+3H2O
[解析]⑵注意电子得失守恒、粒子数目守恒以及物质的选择与系数调整。在反应3NO2+H2O ===2 H++2 NO3-+NO中,只有1个NO2分子作氧化剂,有2个NO2分子作还原剂。2个NO2分子变为2个NO3-离子时,需2个H2O分子提供2个O原子,2个 H2O分子中的4个H原子则变为4个 H+离子。1个NO2分子变成1个NO分子时,另1个O原子需要与2个 H+离子结合成水。所以,有以上“半反应”。⑶前式 + 后式×2即得
[考点分析]氧化还原反应理解21世纪教育网
8. 氮化铝(AlN,Al和N的相对原子质量分别为27和14)广泛应用于电子陶瓷等工业领域。在一定条件下,AlN可通过反应:Al2O3+N2+3C 2AlN+3CO合成。下列叙述正确的是
2AlN+3CO合成。下列叙述正确的是
A.上述反应中,N2是还原剂,Al2O3是氧化剂
B.上述反应中,每生成1 mol AlN需转移3 mol电子
C.AlN中氮的化合价为+3
D.AlN的摩尔质量为41 g
[答案]B
[解析]该反应中 N2降价为氧化剂,C升价为还原剂,每生成1molAlN转移3mol电子,AlN中Al为+3价,N为-3价。D中摩尔质量的单位为g/mol。
[考点分析]氧化还原相关概念的辨析和计算能力
7. 从矿物学资料查得,一定条件下自然界存在如下反应:
14CuSO4+5FeS2 +12H2O====7Cu2S+5FeSO4 +12H2SO4。下列说法正确的是 ( )
A. Cu2S既是氧化产物又是还原产物
B. 5 mol FeS2发生反应,有10 mol电子转移
C. 产物中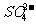 有一部分是氧化产物
有一部分是氧化产物
D. FeS2只作还原剂
[答案]C
[解析]分析反应
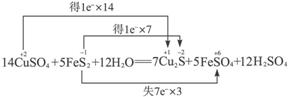
可知,FeS2中S的化合价降低生成Cu2S,升高生成FeSO4,故FeS2既是氧化剂又是还原剂,D错误;CuSO4中Cu的化合价降低生成Cu2S,FeS2中S的化合价也降低生成Cu2S,故Cu2S只是还原产物,非氧化产物,A错误;5
mol FeS2发生反应,有21 mol 电子转移,B错误;产物中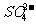 有一部分是氧化产物,另一部分由CuSO4提供,C正确。
有一部分是氧化产物,另一部分由CuSO4提供,C正确。
[考点分析]考查学生对氧化还原相关概念的辨析和计算能力21世纪教育网
6. 钢铁生锈过程发生如下反应:
①2Fe+O2+2H2O=2Fe(OH)2;
②4Fe(OH)2+O2+2H2O=4Fe(OH)3;
③2Fe(OH)3=Fe2O3+3H2O。
下列说法正确的是
A.反应①、②中电子转移数目相等
B.反应①中氧化剂是氧气和水
C.与铜质水龙头连接处的钢质水管不易发生腐蚀
D.钢铁在潮湿的空气中不能发生电化学腐蚀
[答案]A
[解析]反应①2Fe+O2+2H2O=2Fe(OH)2中的氧化剂是O2,1molO2在反应中得到4mol电子,同样在反应②4Fe(OH)2+O2+2H2O=4Fe(OH)3中氧化剂也是O2,而且两个反应中氧气的系数都是1,因此得到的电子均是4mol,故A选项正确B选项错误。钢质水管与铜质水龙头连接后形成原电池,其中钢质水管做负极被腐蚀,故C选项错误。钢铁在潮湿的空气中容易发生电化学腐蚀,而且主要是发生吸氧腐蚀,因此D选项错误。
[考点分析]氧化还原反应的基本概念考查21世纪教育网
5. 下列有关化学与生活的说法不正确的是 ( )
A.采用原煤脱硫技术,可减少燃煤产生的SO2
B.硅酸钠的水溶液俗称水玻璃,可用作木材防腐剂
C.自来水厂可用氯气来杀菌消毒,因此氯气无毒
D.维生素C具有还原性,可用作食品抗氧化剂
[答案]C
[解析]根据氯气的性质可以知道氯气是一种有毒的气体,因氯气与水反应生成的HClO具有强氧化性,所以常用氯气对自来水消毒杀菌。因此C选项是错误的21世纪教育网
[考点分析]化学与生活综合运用
4. 锌与很稀的硝酸反应生成硝酸锌、硝酸铵和水。当生成1 mol硝酸锌时,被还原的硝酸的物质的量为
A.2 mol B.1 mol C.0.5 mol D.0.25 mol
[答案]D
[解析]:此题主要考查氧化还原反应的配平:Zn+HNO3(稀) Zn(NO3)2+NH4NO3+H2O,Zn:0→+2,化合价改变值为:(2-0)×1=2,N:+5→-3,化合价的改变值为:(5+3)×1=8,根据化合价升降总值相等得:在Zn(NO3)2前配4,NH4NO3前配1,然后根据反应前后各元素的原子个数相等,找出其他物质的系数。配平后的化学方程式为:4Zn+10HNO3(稀)===4Zn(NO3)2+NH4NO3+3H2O,当生成1mol的Zn(NO3)2时,被还原的HNO3为0.25mol21世纪教育网
Zn(NO3)2+NH4NO3+H2O,Zn:0→+2,化合价改变值为:(2-0)×1=2,N:+5→-3,化合价的改变值为:(5+3)×1=8,根据化合价升降总值相等得:在Zn(NO3)2前配4,NH4NO3前配1,然后根据反应前后各元素的原子个数相等,找出其他物质的系数。配平后的化学方程式为:4Zn+10HNO3(稀)===4Zn(NO3)2+NH4NO3+3H2O,当生成1mol的Zn(NO3)2时,被还原的HNO3为0.25mol21世纪教育网
[考点分析]氧化还原反应的计算
3. 物质的量之比为2:5的锌与稀硝酸反应,若硝酸被还原的产物为N2O,反应结束后锌没有剩余,则该反应中被还原的硝酸与未被还原的硝酸的物质的量之比是
A. 1:4 B.1:5 C. 2:3 D.2:5
[答案]A
[解析]设2molZn参与反应,因Zn无剩余,则最终生成了2molZn(NO3)2,显然含有4mol ,这部分是没有参与氧化还原反应的HNO3,根据得失电子守恒有:2×n(Zn)=n(HNO3)×4,则n(HNO3)=1mol,即有1molHNO3被还原。
,这部分是没有参与氧化还原反应的HNO3,根据得失电子守恒有:2×n(Zn)=n(HNO3)×4,则n(HNO3)=1mol,即有1molHNO3被还原。
[考点分析]氧化还原反应的计算
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com