
1.周期表中特殊位置的元素
①族序数等于周期数的元素:H、Be、Al、Ge。
②族序数等于周期数2倍的元素:C、S。
③族序数等于周期数3倍的元素:O。
④周期数是族序数2倍的元素:Li、Ca。
⑤周期数是族序数3倍的元素:Na、Ba。
⑥最高正价与最低负价代数和为零的短周期元素:C。
⑦最高正价是最低负价绝对值3倍的短周期元素:S。
⑧除H外,原子半径最小的元素:F。
⑨短周期中离子半径最大的元素:P。
0.5a
③
m
g(g≥2m)
2(g-2m)
(g-m)•a
(2)定T、P下的等效平衡(例4: 与例3的相似。如将反应换成合成氨反应)
Ⅲ类:在T、P相同的条件下,改变起始加入情况,只要按化学计量数换算成平衡式左右两边同一边物质的物质的量之比与原平衡相同,则达到平衡后与原平衡等效。
四十五、元素的一些特殊性质
0.5
1
0.5a
③
m
g(g≥2m)
答 案:
已知
编号
起始状态物质的量(mol)
平衡时HBr的物质的量(mol)
H2
Br2
HBr
1
2
0
a
①
2
4
0
2a
②
0
答案:① 2 ② 0.25 、 1.5 ③a+c=2
b+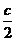 =1
=1
例2:在一个容积固定的密闭容器中,加入m molA、n molB,发生反应:
mA(g)+nB(g)==pC( g),平衡时C的浓度为w mol•L-1。若容器体积和温度不变,起始时放入a molA,b molB,c molC,要使平衡后C的浓度仍为w mol•L-1,则a、b、c必须满足的关系是:(C)
A、a:b:c=m:n:p B、a:b=m:n ,ap/m +b=p
C、mc/p +a=m ,nc/p +b=n D、a=m/3 b=m/3 c=2p/3
Ⅱ类:在定T、V情况下,对于反应前后气体分子数不变的可逆反应,只要反应物(或生成物)的物质的量的比例与原平衡相同,则二平衡等效。
例3:在一个固定体积的密闭容器中,保持一定温度进行以下反应:
H2(g)+Br2(g)==2HBr(g),已知加入1mol H2和2molBr2时,达到平衡后生成a molHBr(见下表已知项)在相同条件下,且保持平衡时各组分的体积分数不变,对下列编号①~③的状态,填写表中的空白。
已知
编号
起始状态物质的量(mol)
平衡时HBr的物质的量(mol)
H2
Br2
HBr
1
2
0
a
①
2
4
0
②
1
②若a=0.5,则b= 和c= 。
③a、b、c必须满足的一般条件是(请用两个方程式表示,其中一个只含a和c,另一个只含b和c): 、
2、等效平衡的分类
(1)定温(T)、定容(V)条件下的等效平衡
Ⅰ类:对于一般可逆反应,在定T、V条件下,只改变起始加入情况,只要通过可逆反应的化学计量数比换算成平衡式左右两边同一边物质的物质的量与原平衡相同,则二平衡等效。
例1:在一定温度下,把2molSO2和1molO2通入一个一定容积的密闭容器里,发生如反应:2SO2+O2 ==2SO3(g),当此反应进行到一定程度时,反应混合物处于化学平衡状态。维持该容器中温度不变,令a、b、c分别代表初始加入的SO2、O2和SO3的物质的量(mol)。如a、b、c取不同的数值,它们必须满足一定的相互关系,才能保证达到平衡时,反应混合物中三种气体的体积分数仍跟上述平衡时完全相同,请填写下列空白:
①若a=0,b=0,则c= 。
1、等效平衡的含义
在一定条件(定温、定容或定温、定压)下,只是起始加入情况不同的同一可逆反应达到平衡后,任何相同组分的分数(体积、物质的量)均相同,这样的化学平衡互称等效平衡。
4.原电池与电解池的比较
原电池
电解池
(1)定义
化学能转变成电能的装置
电能转变成化学能的装置
(2)形成条件
合适的电极、合适的电解质溶液、形成回路
电极、电解质溶液(或熔融的电解质)、外接电源、形成回路
(3)电极名称
负极
正极
阳极
阴极
(4)反应类型
氧化
还原
氧化
还原
(5)外电路电子流向
负极流出、正极流入
阳极流出、阴极流入
3.原电池:把化学能转变为电能的装置
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com