
6. 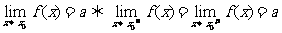
其中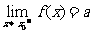 表示当
表示当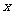 从左侧趋近于
从左侧趋近于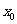 时的左极限,
时的左极限,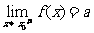 表示当
表示当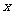 从右侧趋近于
从右侧趋近于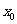 时的右极限
时的右极限 
5. 趋向于定值的函数极限概念:当自变量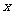 无限趋近于
无限趋近于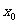 (
(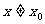 )时,如果函数
)时,如果函数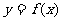 无限趋近于一个常数
无限趋近于一个常数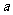 ,就说当
,就说当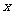 趋向
趋向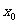 时,函数
时,函数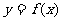 的极限是
的极限是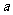 ,记作
,记作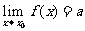
 特别地,
特别地,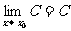 ;
;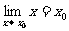

4.常数函数f(x)=c.(x∈R),有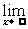 f(x)=c.
f(x)=c.
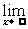 f(x)存在,表示
f(x)存在,表示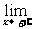 f(x)和
f(x)和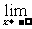 f(x)都存在,且两者相等.所以
f(x)都存在,且两者相等.所以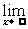 f(x)中的∞既有+∞,又有-∞的意义,而数列极限
f(x)中的∞既有+∞,又有-∞的意义,而数列极限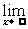 an中的∞仅有+∞的意义
an中的∞仅有+∞的意义

3.函数极限的定义:
(1)当自变量x取正值并且无限增大时,如果函数f(x)无限趋近于一个常数a,就说当x趋向于正无穷大时,函数f(x)的极限是a.
记作: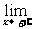 f(x)=a,或者当x→+∞时,f(x)→a.
f(x)=a,或者当x→+∞时,f(x)→a.
(2)当自变量x取负值并且绝对值无限增大时,如果函数f(x)无限趋近于一个常数a,就说当x趋向于负无穷大时,函数f(x)的极限是a.
记作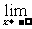 f(x)=a或者当x→-∞时,f(x)→a.
f(x)=a或者当x→-∞时,f(x)→a.
(3)如果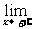 f(x)=a且
f(x)=a且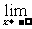 f(x)=a,那么就说当x趋向于无穷大时,函数f(x)的极限是a,记作:
f(x)=a,那么就说当x趋向于无穷大时,函数f(x)的极限是a,记作: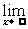 f(x)=a或者当x→∞时,f(x)→a.
f(x)=a或者当x→∞时,f(x)→a.
2.几个重要极限:
(1)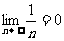 (2)
(2)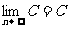 (C是常数)
(C是常数)
(3)无穷等比数列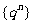 (
(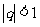 )的极限是0,即
)的极限是0,即 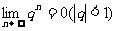

1.数列极限的定义:
一般地,如果当项数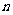 无限增大时,无穷数列
无限增大时,无穷数列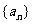 的项
的项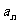 无限趋近于某个常数
无限趋近于某个常数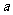 ,那么就说数列
,那么就说数列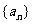 以
以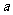 为极限.记作
为极限.记作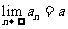 .
.
16、(2010·潍坊模拟)A+B→X+Y+H2O(未配平,反应条件略去)是中学常见反应的化学方程式,其中A、B的物质的量之比为1:4。请回答:
(1)若Y是黄绿色气体,则Y的化学式是 ,该反应的化学方程式是:
。
(2)若A为非金属单质,构成它的原子核外最外层电子数是次外层电子数的2倍,B的溶液为某浓酸,则反应中氧化剂与还原剂的物质的量之比是 。
(3)若A为金属单质,常温下A在B的浓溶液中“钝化”,且A可溶于X溶液中
①A元素在周期表中的位置是 (填所在周期和族);Y的化学式是 。
②含a mol X的溶液溶解了一定量A后,若溶液中两种金属阳离子的物质的量恰好相等,则被还原的X是 mol。
(4)若A、B、X、Y均为化合物。A溶于水电离出的阳离子和水作用的生成物可净化水,向A溶液中加入硝酸酸化的AgNO3溶液,产生白色沉淀;B的焰色为黄色。则A与B按物质的量之比1:4恰好反应后,溶液中离子浓度从大到小的顺序是
[解析](1)若Y是黄绿色气体,则Y为Cl2。
(2)构成A的原子核外最外层电子数是次外层电子数的2倍,则Y为碳,B为浓硝酸.
(3)A为金属单质,常温下A在B的浓溶液中“钝化”,则A为Al或Fe, X应为铝盐或铁盐,又因A可溶于X溶液中,故可推知A为Fe,Fe在周期表的位置是第4周期 Ⅷ族。
Fe+ 2Fe3+ = 3Fe2+
m 2m 3m
由题意得:a-2m=3m m=0.2a 故被还原的n(Fe3+)=2m=0.4a
(4)化合物A溶于水电离出的阳离子和水作用的生成物可净化水,且A的水溶液与硝酸酸化的AgNO3溶液能产生白色沉淀,可知化合物A为AlCl3。B的焰色为黄色,故应为钠的化合物。因为A与B按物质的量之比1:4恰好反应,可知B为NaOH,反应为AlCl3+4NaOH=NaAlO2+3NaCl+2H2O ,所以反应后的溶质为NaAlO2和NaCl,且溶液显碱性,溶液中离子浓度从大到小的顺序是c(Na+)>c(Cl-)>
c(AlO2-)>c(OH-)>c(H+)。
[答案](1)Cl2 ; MnO2+4HCl(浓)  MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(2)4:1 ; (3)①第4周期 Ⅷ族 ;NO ; ②0.4a
(4)c(Na+)>c(Cl-)>c(AlO2-)>c(OH-)>c(H+)
()
15、(2010·曲靖模拟)下图表示各物质之间的转化关系,其中A、B、C、G为单质。②为工业生产中常见反应,E是一种具有漂白作用的盐,Y易潮解,M是一种两性化合物,L是一种白色沉淀。
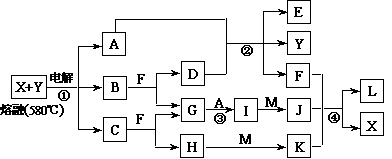
试回答下列有关问题:
(1)M的化学式 ,Y在实验室中的用途 (列举一例)。
(2)X的熔点为801℃,实际工业冶炼中常常加入一定量的Y共熔,猜想工业上这样做的目的: 。工业生产中,还常常利用电解X和F的混合物制取 。
(3)反应②的化学方程式是___________。
(4)反应④的离子反应方程式是 。
[解析]根据E是一种具有漂白作用的盐,Y易潮解,判断E为Ca(ClO)2,Y为CaCl2,则A和D为氯气和氢氧化钙,F为水,M为氧化铝,L为氢氧化铝。
[答案](1)Al2O3 用作干燥剂
(2)降低X、Y熔化时的温度,节约能源 Cl2、H2和NaOH
(3)2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
(4)Al3++3AlO2-+6H2O=4Al(OH)3↓
14、(2010·信阳模拟)由短周期元素组成的A、B两种盐可发生下列变化.且B的焰色反应呈黄色(图中其它生成物未列出)
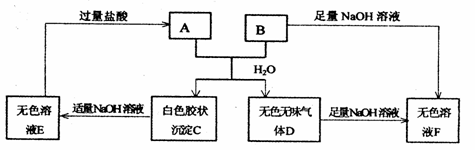
(1)A和B的混合物溶于水发生反应的离子方程式______________________________
(2)B、E两溶液混合反应时,可观察到的现象是_________________________________,
写出B→F反应的离子方程式________________
[答案](1)Al3++HCO3-==== Al(OH)3↓+CO2↑
(2)生成白色胶状沉淀 HCO3-+OH-====CO32-+H2O
13、(2010·南阳模拟)含有Ca2+、Mg2+、HCO3-的水在加热过程中会发生如下反应而形成水垢:
Ca(HCO3)2  CaCO3↓+CO2↑+H2O
CaCO3↓+CO2↑+H2O
Mg(HCO3)2  MgCO3↓+CO2↑+H2O
MgCO3↓+CO2↑+H2O
MgCO3 + H2O  Mg(OH)2 + CO2↑
Mg(OH)2 + CO2↑
某学生为研究水垢的成分,取一定量水垢经加热使其失去结晶水并干燥后称得质量为11.56 g,高温灼烧后残留固体为CaO和MgO,放出的气体用过量的Ba(OH)2溶液吸收,得到23.64 g沉淀。
(1)通过计算确定水垢中是否含有碳酸镁。
(2)残留固体经冷却后称得质量为5.92 g,计算水垢中各成分的物质的量。
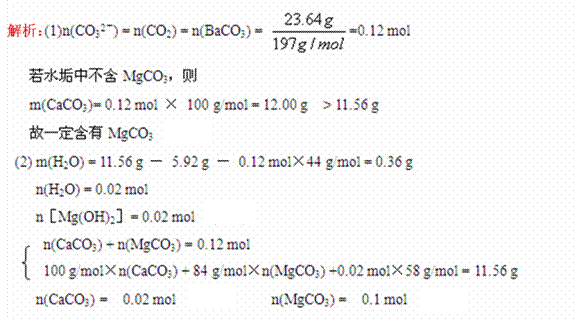
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com