
3.) CaC2 + H2O === C2H2↑+ Ca(OH)2
2.) 2Mg + O2 ===2MgO
1.) Na2S2O3 + H2SO4 == Na2SO4 + SO2 + S↓+ H2O
或 S2O32- + 2H+ == SO2 + S↓+ H2O
2.把除去氧化膜的镁条放入一定浓度的稀盐酸的试管中,发现H2的生成速度V随时间t变化如图。其中t1--t2速度变化的原因是___________________ ;t2--t3速度变化的原因是_________________________________。
 V
V
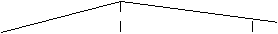








 t 1
t 2
t 3
t 1
t 2
t 3
[实验事实的处理]1.写化学方程式或离子方程式
3. 对可逆反应而言,正催化剂使正、逆反应速率都加快,且加快的程度相同。相反,负催化剂使正、逆反应速率都减小,且减小的程度相同。
[应用]催化剂在现代化学和化工生产中占有极为重要的地位。大约85%的反应需要催化剂。尤其是现代大型化工业、石油工业中,很多反应还必须使用性能良好的催化剂。例;接触法制硫酸工业。
[课堂练习]1.要使在容积恒定的密闭容器中进行的可逆反应2A(气)+B(固)== 2C(气)+Q(Q>0)的正反应速率显著加快,可采用的措施是(不考虑固、气态间的接触面积)( )
A.降温 B.加入B C.增大体积使压强减小 D.加入A
2. 能加快反应速率的催化剂叫正催化剂;能减慢化学反应速率的催化剂叫负催化剂。
[提出问题]催化剂是怎样影响化学反应速率的?
[收集事实]途径:1.观察演示实验。2.回顾已有知识
(演示实验)过氧化氢分解的对比实验
(复习回顾)用KClO3制氧气的实验
[实验事实的处理]1.写化学方程式
(1) 2H2O2 == 2H2O + O2↑
(2) 2KClO3 == 2KCl +3O2↑
2. 列表对比
(1)过氧化氢分解实验的对比表
|
编号 |
无催化剂时的反应情况 |
有催化剂时的反应情况 |
|
1 |
|
|
|
2 |
|
|
(2)用KClO3制氧气实验的对比表
|
编号 |
无催化剂时的反应情况 |
有催化剂时的反应情况 |
|
1 |
|
|
|
2 |
|
|
[表征性抽象]催化剂能加快化学反应速率。
[原理性抽象]为什么催化剂能加快化学反应速率?
(明确)当温度和反应物浓度一定时,使用催化剂可使反应途径发生改变,从而降低了反应的活化能,使得活化分子的百分比增大,因此活化分子的数目增多,有效碰撞频率增大,故
化学反应速率加大。
[对结论的再认识]1.催化剂改变化学反应速率的原因仅仅是改变始态到终态的途径,不改变反应的结果。例:
(1)在加热条件下: 2Cu + O2 == 2CuO
2CuO +2 CH3CH2OH == 2Cu +2 CH3CHO + 2H2O
(2)氮的氧化物破坏臭氧: NO + O3 == NO2 + O2
NO2 + O ==NO + O2
3. 为防止食品变质,我们将食品放入冰箱中保存,以降低食品变质的速率。
2. 合成氨工业中,是在500℃的条件下进行反应,以加快反应进行的速度。
2. 表格化
(1)同浓度的Na2S2O3溶液在不同温度下与0.1摩/升的硫酸10毫升反应的对比表
|
编 号 |
0.1mol/L的 Na2S2O3 |
0.1mol/L的 H2SO4 |
反应温度 (℃) |
反应中出现浑浊的时间 (秒) |
|
1 |
10ml |
10ml |
冷水 |
|
|
2 |
10ml |
10ml |
热水 |
|
(2)Cu与浓硫酸在常温条件下和在加热条件下反应情况对比表
|
编号 |
Cu与浓硫酸在常温条件下反应 |
Cu与浓硫酸在加热条件下反应 |
|
1 |
|
|
|
2 |
|
|
(3)Mg条分别与冷水和沸水的反应情况对比表
|
编号 |
Mg条与冷水反应 |
Mg条与热水反应 |
|
1 |
|
|
|
2 |
|
|
[表征性抽象]在其它条件不变的情况下,升高温度,化学反应要加快。经过实验测定,温度每升高10℃,反应速率通常要增大到原来的2~4倍。
[原理性抽象]为什么升高温度会使反应速率加快?
(明确)当反应物浓度一定时,分子总数一定,升高温度,反应物分子的能量增高,是活化分子的百分比增大,因而活化分子数量增多,有效碰撞频率增大,所以,反应速率加大。
[对结论的再理解]对于可逆反应来说,升高体系的温度,反应物和生成物中的活化分子数都增加,所以,正反应的速率和逆反应的速率都增大。
[应用]1.在实验室进行化学反应时,常常通过给反应物加热来增大反应的速率。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com