
3.本题还有很大的拓展空间:如根据电荷守恒是否可以推出K+ 的物质的量一定是0.02mol吗?结论也是不一定,如果不含有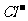 则根据电荷守恒知K+是0.02mol,如果溶液中含有含有
则根据电荷守恒知K+是0.02mol,如果溶液中含有含有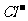 ,则K+的物质的量大于0.02mol。
,则K+的物质的量大于0.02mol。
2.本题隐性考查了一个重要的化学思想:电解质溶液中的电荷守恒思想。如果不具备电荷守恒思想,很容易漏掉K+,或者造成认为K+无法判断的错误结论。
1.和传统离子共存题相比:本题不但在推断题中考查了离子共存,并且考查了定量问题和定量计算,这是离子共存问题的一个大的跨越,也是值得关注的一个命题动向。
11. 今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+
、Cl-、Mg2+、Ba2+、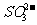 、
、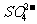 ,现取三份100 mL溶液进行如下实验:
,现取三份100 mL溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液加热后,收集到气体0.04 mol
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27 g,经足量盐酸洗涤、干燥后,沉淀质量为2.33 g。根据上述实验,以下推测正确的是 ( )
A.K+一定存在 B.100 mL溶液中含0.01 mol CO32 -
C.Cl-可能存在 D.Ba2+一定不存在,Mg2+可能存在
[答案]A、C。
[解析]由步骤(1)可知,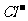 、
、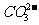 、
、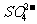 三者中至少有一种;由步骤(2)可知,生成的气体是氨气,则一定有NH4+且可算出有NH4+0.04mol;由步骤(3)可知,①有BaSO4 2.33 g(即0.01 mol),即有0.01 mol SO42
-;②有BaCO3为6.27 g-2.33 g = 3.94 g(即0.02 mol),即CO32 -有0.02 mol;③考虑到离子共存问题,可知原溶液中无Mg2+、Ba2+,Cl-可能存在。再考虑到电荷守恒,由于n(NH4+ )<2n(
三者中至少有一种;由步骤(2)可知,生成的气体是氨气,则一定有NH4+且可算出有NH4+0.04mol;由步骤(3)可知,①有BaSO4 2.33 g(即0.01 mol),即有0.01 mol SO42
-;②有BaCO3为6.27 g-2.33 g = 3.94 g(即0.02 mol),即CO32 -有0.02 mol;③考虑到离子共存问题,可知原溶液中无Mg2+、Ba2+,Cl-可能存在。再考虑到电荷守恒,由于n(NH4+ )<2n(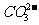 )+2n(
)+2n(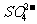 ),由电荷守恒可知,阳离子除了NH4+外必定还有K+
),由电荷守恒可知,阳离子除了NH4+外必定还有K+
[考点分析]离子共存问题在推断中的延伸
[思维深化]
10. 某固体混合物可能含有MgCO3、Al2(SO4)3、Na2SO4Ba(NO3)2、AgNO3和CuSO4,将该混合物进行如下实验,根据所给实验现象完成表格(对于可能确定的物质在相应位置写化学式,暂不能确定的物质在相应位置填“无”)。
(1)将少许固体放入水中得到无色溶液和白色沉淀。
|
肯定存在的物质 |
肯定不存在的物质 |
理由 |
|
|
|
|
(2)取溶液进行焰色反应,火焰呈黄色。
|
肯定存在的物质 |
肯定不存在的物质 |
理由 |
|
|
|
|
(3)取白色沉淀加入稀盐酸,沉淀完全溶解并放出气体。
|
肯定存在的物质 |
肯定不存在的物质 |
理由 |
|
|
|
|
(4)通过上述实验仍无法确定的物质是__________________。
答案:(1)
|
无 |
CuSO4 |
溶液无色,而CuSO4为蓝色 |
(2)
|
Na2SO4 |
无 |
Na的焰色反应呈黄色 |
(3)
|
MgCO3 |
Ba(NO3)2
AgNO3 |
MgCO3溶于HCl,生成CO2;如有Ba(NO3)2和AgNO3均与Na2SO3反应, 生成BaSO4和Ag2SO4均不溶于HCl。 |
(4)Al2(SO4)3。21世纪教育网
[解析](1)由于溶液无色,所以CuSO4就一定不存在,因为CuSO4溶液为蓝色,MgCO3微溶于水,Al2(SO4)3、Na2SO4和Ba(NO3)2、AgNO3中的任意一种反应均可产生白色沉淀,具体物质不能确定。
(2)进行焰色反应,火焰呈黄色,说明一定有Na+存在,即一定有Na2SO4,其它物质不能确定。
(3)白色沉淀加入稀盐酸,沉淀完全溶解,且放出气体,说明沉淀为MgCO3,由于有Na2SO4存在,所以Ba(NO3)2和AgNO3均不能存在,溶液中是否有Al2(SO4)3不能肯定
[考点分析]常见离子的检验
9. 下列各组物质的无色溶液,不用其它试剂即可鉴别的是 ( )
①KOH Na2SO4 AlCl3 ②NaHCO3 Ba(OH)2 H2SO4
③HCl NaAlO2 NaHSO4 ④Ca(OH)2 Na2CO3 BaCl2
A.①② B.②③ C.①③④ D.①②④
[答案]A
[解析]①中KOH和AlCl3互滴现象不同,另一种是Na2SO4,可以鉴别;②中H2SO4和NaHCO3生成气体,和Ba(OH)2生成白色沉淀,可以鉴别;③中HCl和NaHSO4与NaAlO2反应的现象不同,不能鉴别;④中Ca(OH)2和BaCl2与Na2CO3反应现象相同,不能鉴别
[考点分析]常见元素化合物的性质,物质的检验知识本题考查了常见物质在溶液中的反应,解答此类题目要求学生熟练掌握常见的化学反应,特别是一些特殊的反应,例如反应物比例不同对产物有影响的反应,如铝盐与强碱的反应,碳酸钠和盐酸的反应等。
8. 有BaCl2和NaCl的混合溶液aL,将它均分成两份。一份滴加稀硫酸,使Ba2+离子完全沉淀;另一份滴加AgNO3溶液,使Cl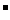 离子完全沉淀。反应中消耗xmol H2SO4、ymol AgNO3。据此得知原混合溶液中的c(Na+)/ mol·L-1为
( )
离子完全沉淀。反应中消耗xmol H2SO4、ymol AgNO3。据此得知原混合溶液中的c(Na+)/ mol·L-1为
( )
A.(y-2x)/a B.(y-x)/a C.(2y-2x)/a D.(2y-4x)/a
[答案]D
[解析]本题的解题关键是将溶液分成两份,即每份体积为a/2 L ,n(Ba2+)=n (H2SO4)=xmol,n(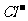 )=n( AgNO3)=ymol,根据电荷守恒
)=n( AgNO3)=ymol,根据电荷守恒
2x[Ba2+]+[Na+]=[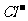 ],在同一溶液中得:2 x n(Ba2+) +n(Na+)=n(
],在同一溶液中得:2 x n(Ba2+) +n(Na+)=n(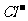 )。N( Na+)=y-2xmol,所以c[Na+]为(y-2x)/2a 即(2y-4x)/a 。
)。N( Na+)=y-2xmol,所以c[Na+]为(y-2x)/2a 即(2y-4x)/a 。
[考点分析]本题考查了关于离子浓度的相关计算。
7. 下列离子方程式正确的是
A.用惰性电极电解饱和氯化钠溶液:2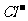 + 2H+
+ 2H+  H2↑+ Cl2↑
H2↑+ Cl2↑
B.用银氨溶液检验乙醛中的醛基:
CH3CHO +2Ag(NH3)2+ + 2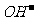

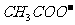 +
+ 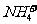 +3NH3 + 3Ag↓+ H2O
+3NH3 + 3Ag↓+ H2O
C.苯酚钠溶液中通入少量CO2:CO2 + H2O + 2C6H5O- 2C6H5OH
+ 2
2C6H5OH
+ 2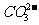
D.Na2SO3溶液使酸性KMnO4溶液褪色:5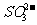 + 6H+ + 2MnO4- == 5
+ 6H+ + 2MnO4- == 5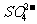 + 2Mn2+ 3H2O
+ 2Mn2+ 3H2O
[答案]B、D
[解析]选项A中水为弱电解质,书写离子方程式时不能改写;选项C中正确的离子方程式为:
 -O-+CO2+H2O
-O-+CO2+H2O
 -OH+HCO3-。
-OH+HCO3-。
[考点分析]本题考查离子方程式的书写和正误判断
6. 能正确表示下列反应的例子方程式是
A.向次氯酸钙溶液通入过量CO2:Ca2++2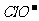 +CO2+H2O =CaCO3↓+2HClO
+CO2+H2O =CaCO3↓+2HClO
B.向次氯酸钙溶液通入SO2:Ca2++2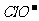 +SO2+H2O= CaSO3↓+2HClO
+SO2+H2O= CaSO3↓+2HClO
C.氢氧化钙溶液与碳酸氢镁溶液反应: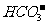 +Ca2++
+Ca2++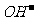 =CaCO3↓+H2O
=CaCO3↓+H2O
D.在氯化亚铁溶液中加入稀硝酸:3Fe2++4H++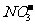 =3Fe3++NO↑+2H2O
=3Fe3++NO↑+2H2O
[答案]D
[解析]A选项CO2过量的话,应该生成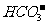 方程式应为:
方程式应为: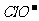 +CO2+H2O=HClO+
+CO2+H2O=HClO+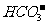 ;B选项HClO可将CaSO3氧化为CaSO4 ,正确的方程式为:Ca2++
;B选项HClO可将CaSO3氧化为CaSO4 ,正确的方程式为:Ca2++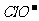 +SO2+H2O=CaSO4↓+
+SO2+H2O=CaSO4↓+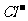 +2H+ ;C选项要考虑到Mg(OH)2 为沉淀即可, Mg2++2
+2H+ ;C选项要考虑到Mg(OH)2 为沉淀即可, Mg2++2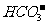 +2Ca2++4
+2Ca2++4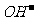 =Mg(OH)2↓+2CaCO3↓+2H2O21世纪教育网
=Mg(OH)2↓+2CaCO3↓+2H2O21世纪教育网
[考点分析]本题考查离子方程式的书写和正误判断,把平时练习中的次氯酸钙与CO2和SO2 反应问题在一个题目中出现,很是少见,四个选项都很常规,都是熟题。难度不大。
5. 下列离子方程式与所述事实相符且正确的是
A.漂白粉溶液在空气中失效: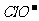 +CO2+H2O=HClO+
+CO2+H2O=HClO+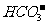
B.用浓盐酸与MnO2反应制取少量氯气:MnO2+2H++2Cl- Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
C.向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO2-+CO2+2H2O=Al(OH)3↓+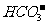
D.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3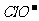 +2Fe(OH)3=2
+2Fe(OH)3=2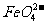 +3
+3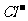 +H2O+4H+
+H2O+4H+
[答案]C
[解析]漂白粉失效的化学方程式为Ca(ClO)2+H2O+CO2=CaCO3+2HClO,那么该反应的离子方程式是Ca2++2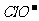 +H2O+CO2=CaCO3+2HClO,A项错;实验室制取Cl2的原理是浓盐酸和二氧化锰反应,离子方程式为MnO2+4H++2
+H2O+CO2=CaCO3+2HClO,A项错;实验室制取Cl2的原理是浓盐酸和二氧化锰反应,离子方程式为MnO2+4H++2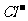
 Mn2++Cl2↑+2H2O,所以B项错;D项,在强碱溶液中,不可能生成H+,所以D错。
Mn2++Cl2↑+2H2O,所以B项错;D项,在强碱溶液中,不可能生成H+,所以D错。
[考点分析]离子方程式的正确书写
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com