
2. 某厂废水中含5.00×10-3mol·L-1的
某厂废水中含5.00×10-3mol·L-1的 ,其毒性较大。某研究性学习小组为了变废为宝,将废水处理得到磁性材料
,其毒性较大。某研究性学习小组为了变废为宝,将废水处理得到磁性材料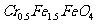 (
(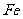 的化合价依次为+3、+2),设计了如下实验流程:
的化合价依次为+3、+2),设计了如下实验流程:
(1)第①步反应的离子方程式是
(2)第②步中用PH试纸测定溶液PH的操作是:
(3)第②步过滤得到的滤渣中主要成分除Cr(OH)3外,还有
(4)欲使1L该废水中的 完全转化为
完全转化为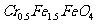 。理论上需要加入
。理论上需要加入
GFeSO4·7H2O。
[答案]
(1)Cr2O72- + 6Fe2+ + 14H+
 2Cr3+
+ 6Fe3+ + 7H2O
2Cr3+
+ 6Fe3+ + 7H2O
(2)将一小块pH试纸放在表面皿上,用玻璃棒蘸取少量待测液,点在pH试纸上,再与标准比色卡对照。
1.(09全国卷Ⅱ29)
现有A、B、C、D、E、F六种化合物,已知它们的阳离子有 ,
, 阴离子有
阴离子有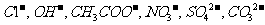 ,现将它们分别配成
,现将它们分别配成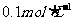 的溶液,进行如下实验:
的溶液,进行如下实验:
测得溶液A、C、E呈碱性,且碱性为A>E>C;
向B溶液中滴加稀氨水,先出现沉淀,继续滴加氨水,沉淀消失;
向D溶液中滴加 溶液,无明显现象;
溶液,无明显现象;
向F溶液中滴加氨水,生成白色絮状沉淀,沉淀迅速变成灰绿色,最后变成红褐色。
根据上述实验现象,回答下列问题:
实验②中反应的化学方程式是
;
(2)E溶液是 ,判断依据是
;
(3)写出下列四种化合物的化学式:A 、C 、
D 、F .
[答案]
(1)
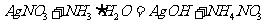

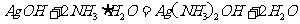
(2)碳酸钾 由①中碱性减弱的顺序可知,E是碳酸盐。六种阳离子中可以与碳酸根形成可溶性盐的只有钾离子,所以E是碳酸钾
(3)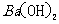


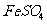
[解析]根据溶液的性质,确定CO32-只能与K+形成显碱性的溶液,另外可能形成的碱性溶液为碱Ba(OH)2
。由于醋酸的酸性大于碳酸,所以醋酸盐水解的碱性小于碳酸盐,因此A为Ba(OH)2,E为K2CO3,C为醋酸盐,由②可得B中阳离子为Ag+,则肯定为AgNO3,由③可得D中无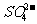 ,则F中的阴离子为
,则F中的阴离子为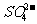 ,D中的阴离子为
,D中的阴离子为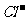 。由④可得F中的阳离子为Fe2+,即F为FeSO4,而
。由④可得F中的阳离子为Fe2+,即F为FeSO4,而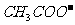 若与Al3+形成溶液时,Al3+也发生水解,所以C为醋酸钙,而D为AlCl321世纪教育网
若与Al3+形成溶液时,Al3+也发生水解,所以C为醋酸钙,而D为AlCl321世纪教育网
[考点分析]本题考查离子共存、盐类水解综合运用。
12. 水体中重金属铅的污染问题备受关注。水溶液中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2、Pb(OH)3-、Pb(OH)42-,各形态的浓度分数α随溶液pH变化的关系如图所示:

[1表示Pb2+,2表示Pb(OH)+,3表示Pb(OH)2,4表示Pb(OH)3-,5表示Pb(OH)42-]
⑴Pb(NO3)2溶液中,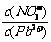 2 (填“>”、“=”、“<”);往该溶液中滴入氯化铵溶液后,
2 (填“>”、“=”、“<”);往该溶液中滴入氯化铵溶液后,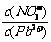 增加,可能的原因是
。
增加,可能的原因是
。
⑵往Pb(NO3)2溶液中滴稀NaOH溶液,pH=8时溶液中存在的阳离子(Na+除外)有
,pH=9时,主要反应的离子方程式为 。
⑶某课题组制备了一种新型脱铅剂,能有效去除水中的痕量铅,实验结果如下表:

 离子
Pb2+
Ca2+
Fe3+ Mn2+ Cl-
离子
Pb2+
Ca2+
Fe3+ Mn2+ Cl-
处理前浓度/(mg·L-1) 0.100 29.8 0.120 0.087 51.9
处理后浓度/(mg·L-1) 0.004 22.6 0.040 0.053 49.8
 上表中除Pb2+外,该脱铅剂对其它离子的去除效果最好的是
。
上表中除Pb2+外,该脱铅剂对其它离子的去除效果最好的是
。
⑷如果该脱铅剂(用EH表示)脱铅过程中主要发生的反应为:
2EH(s)+Pb2+ E2Pb(s)+2H+
E2Pb(s)+2H+
则脱铅的最合适pH范围为 (填代号)。
A.4-5 B.6-7 C.9-10 D.11-12
[答案]⑴> Pb2+与Cl-发生反应,使C(Pb2+)减小。
⑵Pb2+
、Pb(OH)+ 、H+
Pb2++2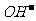 ==Pb(OH)2
==Pb(OH)2
⑶Fe3+ ⑷A
[专题综合]
11. 现有一包铝热剂是铝粉和氧化铁粉末的混合物,在高温下使之充分反应,将反应后的固体分为两等份,进行如下实验(计算pH时假定溶液体积没有变化):
①向其中一份固体中加入100 mL 2.0 mol·L-1的NaOH溶液,加热使其充分反应后过滤,测得滤液的pH=14;
②向另一份固体中加入140 mL 4.0 mol·L-1的HCl溶液,使固体全部溶解,测得反应后所得溶液中只有H+、Fe2+和Al3+三种阳离子且pH=0。计算:
(1)实验①中用去NaOH的物质的量为 ;
(2)这包铝热剂中铝的质量为 ,氧化铁的质量为 ;
(3)实验②产生氢气的体积(标准状况)为 。
[答案]
(1)0.1 mol
(2)5.4 g 9.6 g
(3)2.688 L
10. 在1 L含0.1 mol NaAlO2和0.1 mol Ba(OH)2的混合溶液中,逐滴加入浓度为0.1 mol/L的H2SO4溶液,下列图象中能表示反应产生沉淀的物质的量与加入硫酸溶液体积之间关系的是 ( )
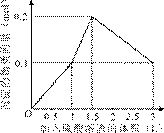
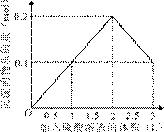
A B
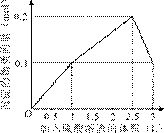

[答案]A
9.(江苏省泗阳中学2009届高三第一次摸底考试)有一无色透明溶液,欲确定是否含有下列离子:Na+、Mg2+、Al3+、Fe2+、Ba2+、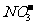 、SO
、SO 、
、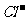 、
、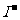 、
、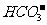 ,取该溶液实验如下:
,取该溶液实验如下:
|
实验步骤 |
实验现象 |
|
①取少量该溶液,加几滴甲基橙 |
溶液变红色 |
|
②取少量该溶液,浓缩,加Cu片和浓H2SO4,加热 |
有无色气体产生,后在空气中又变成红棕色 |
|
③取少量该溶液,加BaCl2溶液 |
有白色沉淀生成 |
|
④取③中上层清液,加AgNO3溶液 |
有白色沉淀生成,且不溶于HNO3 |
|
⑤取少量该溶液,加NaOH溶液 |
有白色沉淀生成,当NaOH过量时沉淀部分溶解 |
(1)溶液中肯定存在的离子是________________________。
(2)溶液中肯定不存在的离子是________________________。
(3)为进一步确定其他离子,应该补充的实验是________ _ ________
。
答案:(7分)(1)Mg2+、Al3+、NO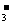 、SO
、SO
(2)Fe2+、Ba2+、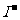 、HCO
、HCO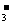
(3)焰色反应,取少量原溶液,加入Ba(NO3)2溶液后,取上层清液加入AgNO3溶液和稀HNO3
8.对下列各组离子的叙述不正确的是 ( )
A.H+、 、Ba2+、
、Ba2+、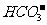 不能在水中大量共存
不能在水中大量共存
B.Mg2+、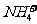 、Fe2+、
、Fe2+、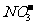 能在酸性溶液中大量共存
能在酸性溶液中大量共存
C.Fe3+、K+、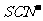 、
、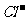 能大量共存且使溶液显红色
能大量共存且使溶液显红色
D.Na+、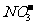 、
、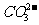 、
、 能在碱性溶液中大量共存
能在碱性溶液中大量共存
答案:BC
7.常温下测得某无色溶液中由水电离出的H+浓度为1×10-13mol/L,又知该溶液中还有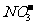 、Na+、
、Na+、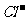 ,那么该溶液中还一定存在的离子是
(
)
,那么该溶液中还一定存在的离子是
(
)
A. 、
、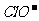 B.Mg2+、、
B.Mg2+、、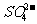 C.Fe2+ 、Cu2+ D.Ba2+、K+
C.Fe2+ 、Cu2+ D.Ba2+、K+
[答案]D
6.在pH=0的无色透明溶液中,因发生氧化还原反应而不能大量共存的离子组是 ( )
A.Na+、K+、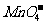 、
、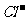 B.
B.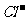 、
、 、K+、Na+
、K+、Na+
C.Na+、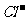 、
、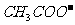 、K+ D.K+、
、K+ D.K+、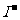 、Na+、
、Na+、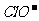
[答案]BD
5.某能使石蕊试液变红的溶液中,能大量存在的离子是 ( )
A.Al3+ 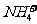
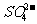
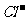 B.Na+ Mg2+
B.Na+ Mg2+ 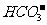
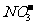
C.K+ Na+ 
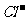 D.Fe2+ K+ NO3-
D.Fe2+ K+ NO3- 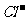
[答案]A
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com