
24.(14分) 为了减少CO对大气的污染,某研究性学习小组拟研究CO和H2O反应转化为绿色能源H2。已知:
2CO(g)+O2(g)=2CO2(g);ΔH=-566kJ·moL-1
2H2(g)+O2(g)=2H2O(g);ΔH=-483.6KJ·moL-1
H2O (g)=H2O(l);ΔH=-44.0KJ·moL-1
(1)氢气的燃烧热△H= kJ·moL-1
(2)写出CO和H2O(g)作用生成CO2和H2的热化学方程式 。
(3)往 1L体积不变的容器中加入1.00mol CO和1.00mol H2O(g),在t℃时反应并达到平衡,若该反应的化学平衡常数K=1,则t℃时CO 的转化率为 ;反应达到平衡后,升高温度,此时平衡常数将 (填“变大”、“不变”或“变小”),平衡将向 (填“正”或“逆”)方向移动。
(4)为了提高CO的转化率,可采取的措施是 。
A.增大的CO浓度 B.增大的H2O(g)浓度 C.使用催化剂 D.降低温度
(5)H2是一种理想的绿色能源,可作燃料电池;若该氢氧燃料电池以KOH为电解质溶液,其负极的电极反应式是
23.I.(4分)(1)同浓度的下列溶液:①NH4Al(SO4)2 ②NH4Cl ③CH3COONH4,其中
c(NH4+) 由大到小的顺序是 (填序号,下同)
(2)同浓度的下列溶液:①(NH4)2SO4 ②NH4Cl ③Na2CO3 ④NaHCO3,其中
PH 由大到小的顺序是
II.(6分)(1)明矾[KAl(SO4)2·12 H2O]水溶液呈 性 ,原因是(用离子方程表示): 。试列举它在生活中的一种用途 ;
(2)把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是 ;(用化学式表示,下同)
(3)在配制硫化钠溶液时,为了防止发生水解,可以加入少量的 。
22. 根据化学平衡知识,判断下列说法正确的是( )
A.已知NaHA溶液呈弱碱性,则该溶液中下列各种微粒浓度大小排列顺序为:
c(Na+)>c(HA-)>c(A2-)>c(H2A)
B.在小苏打溶液中存在下列关系:c(HCO3-)=c(Na+)-c (CO32-)-c(H2CO3)
C.常温下,同浓度的一元酸HA比HB易电离,则相同浓度的NaA溶液比NaB溶液的pH大
D.常温下,稀释0.1 mol/L的氨水,溶液中c(OH-)、c(NH4+)、c(H+)均下降
21.下列叙述正确的是( )
A.将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO42-)>c(NH4+)
B.两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2
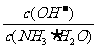 C.pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色
C.pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色
D.向0.1 mol/L的氨水中加入少量硫酸铵固体,则溶液中 增大
20.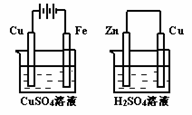 右图两个装置中,溶液体积均为200mL,开始时,电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得导线上都通过了0.02mol
e一,若不考虑溶液体积的变化,则下列叙述正确的是( )
右图两个装置中,溶液体积均为200mL,开始时,电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得导线上都通过了0.02mol
e一,若不考虑溶液体积的变化,则下列叙述正确的是( )
A.在①中Cu棒为阳极;在②中Cu棒为负极
B.电极上析出物质的质量:①<②
C.电极反应式:①中阳极:4OH一一4e一= 2H2O+O2↑;
|
|
D.溶液的pH:①不变;②增大
19.相同温度下,100mL 0.01mol/L的醋酸溶液与10mL 0.1mol/L的醋酸溶液相比较,下列数值前者大于后者的是( )
A.中和时所需NaOH的量 B.c(H+)
C.c(OH-) D.c(CH3COOH)
18.工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g) Si(s)+4HCl(g);△H=+QkJ/mol(Q>0)某温度、压强下,将一定量反应物通入密闭容器进行以上反应(此条件下为可逆反应),下列叙述正确的是(
)
Si(s)+4HCl(g);△H=+QkJ/mol(Q>0)某温度、压强下,将一定量反应物通入密闭容器进行以上反应(此条件下为可逆反应),下列叙述正确的是(
)
A. 反应过程中,若增大压强能提高SiCl4的转化率
B. 若反应开始时SiCl4为1mol,则达平衡时,吸收热量为QkJ
C. 反应至4min时,若HCl浓度为0.12mol/L,则H2的反应速率为0.03mol/(L min)
min)
D. 当反应吸收热量为0.025QkJ时,生成的HCl通入100mL 1mol/L的NaOH溶液恰好反应
16.在恒温恒容下,对反应CO2(g)+H2(g)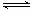 CO(g)+H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表
CO(g)+H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表
|
|
CO2 |
H2 |
CO |
H2O |
|
甲 |
amol |
amol |
0mol |
0mol |
|
乙 |
2amol |
amol |
0mol |
0mol |
|
丙 |
0mol |
0mol |
2amol |
2amol |
|
丁 |
amol |
0mol |
amol |
amol |
上述四种情况达到平衡后,n(CO)的大小顺序是( )
A.丙>乙=丁>甲 B.乙>丁>甲>丙
C.乙=丁>丙=甲 D.丁>丙>乙>甲
17 .右图装置中,U型管内为红墨水,a、b试管内分别盛有食盐水和氯化铵溶液,各加入生铁块,放置一段时间。下列有关描述错误的是( )
.右图装置中,U型管内为红墨水,a、b试管内分别盛有食盐水和氯化铵溶液,各加入生铁块,放置一段时间。下列有关描述错误的是( )
A.生铁块中的碳是原电池的正极
B.红墨水柱两边的液面变为左低右高
C.两试管中相同的电极反应式是:Fe -2e-= Fe2+
D.a试管中发生了吸氧腐蚀,b试管中发生了析氢腐蚀
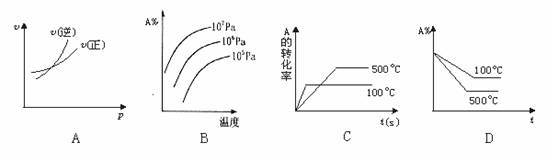
15.对于可逆反应A(g)+2B(g)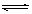 2C(g) ΔH﹥0,下列图象中正确的是( )
2C(g) ΔH﹥0,下列图象中正确的是( )
14. 取浓度相同的NaOH和HCl溶液,以3∶2 体积比相混合,所得溶液的pH =12,则原溶液的浓度为( )
A.0.01 mol•L-1 B.0.017 mol•L-1 C.0.05 mol•L-1 D.0.50 mol•L-1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com