
1.答案:C
解析:原子晶体中一定不存在离子键。只要晶体中存在离子键,就一定是离子晶体,但在离子内部可能含有共价键。在常见的晶体类型中,只有金属晶体的熔沸点差别最大,有熔沸点很高的钨,也有常温下为液态的汞。
31.(1998年上海,27)a、b、c、d、e、f、g为七种由短周期元素构成的粒子,它们都有10个电子,其结构特点如下:
粒子代码: a b c d e f g
原子核数:单核 单核 双核 多核 单核 多核 多核
电荷数: 0 1+ 1- 0 2+ 1+ 0
(单位电荷)
其中b的离子半径大于e的离子半径;d是由极性键构成的四原子极性分子;c与f可形成两个共价型g分子。
试写出:(1)a粒子的核外电子排布式_________________。
(2)b与e相应元素的最高价氧化物对应水化物的碱性强弱比较为:___________>___________ (用化学式表示)。
(3)d溶于水的电离方程式______________________。
(4)g粒子所构成的晶体类型属_________________。
(5)c粒子是_________________,f粒子是_________________(用化学式表示)。
●答案解析
30.(1998年全国,30)BGO是我国研制的一种闪烁晶体材料,曾用于诺贝尔奖获得者丁肇中的著名实验,它是锗酸铋的简称。若知:①在BGO中,锗处于最高价态,②在BGO中,铋的价态与铋跟氯形成某种共价氯化物时所呈的价态相同,在此氯化物中铋具有最外层8电子稳定结构,③BGO可看成是由锗和铋两种元素的氧化物所形成的复杂氧化物,且在BGO晶体的化学式中,这两种氧化物所含的总质量相同。请填空:
(1)锗和铋的元素符号分别是_________________和_________________。
(2)BGO晶体的化学式是_________________。
(3)BGO晶体中所含铋的氧化物化学式是_______________________________________。
29.(1999年全国,33)(1)中学教材上图5-3表示NaCl晶体结构,它向三维空间延伸得到完美晶体。NiO(氧化镍)晶体的结构与NaCl相同,Ni2+与最邻近O2-的核间距离为a×10-8cm,计算NiO晶体的密度(已知NiO的摩尔质量为74.7 g·mol-1)。
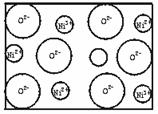
(2)天然的和绝大部分人工制备的晶体都存在各种缺陷,例如在某种NiO晶体中就存在如右图所示的缺陷:一个Ni2+空缺,另有两个Ni2+被两个Ni3+所取代。其结果晶体仍呈电中性,但化合物中Ni和O的比值却发生了变化。某氧化镍样品组成为Ni0.97O,试计算该晶体中
Ni3+与Ni2+的离子数之比。
28.(2000年广东,25)(1)下列物质结构图中,●代表原子序数从1到10的元素的原子实(原子实是原子除去最外层电子后剩余的部分),小黑点代表未用于形成共价键的最外层电子,短线代表价键,(示例:F2 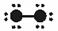 )
)

根据各图表示的结构特点,写出该分子的化学式:
A: B: C: D:
(2)在分子的结构式中,由一个原子提供成键电子对而形成的共价键用“→”表示,例如:

硫酸 写出三硝酸甘油酯的结构式:
。
27.(1994年上海,12)下列各组物质中,按熔点由低到高排列正确的是
A.O2、I2、Hg B.CO2、KCl、SiO2
C.Na、K、Rb D.SiC、NaCl、SO2
26.(1994年上海,13)下列各组物质中,都是由极性键构成的极性分子的一组是
A.CH4和Br2 B.NH3和H2O
C.H2S和CCl4 D.CO2和HCl
25.(1994年上海,6)下列电子式中,正确的是
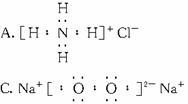
24.(1995年上海,16)下列判断不正确的是
A.SO2具有可燃性 B.H2SO4不是离子化合物
C.芒硝是硫酸盐 D.CS2的电子式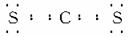
23.(1995年全国,1、2、3)请分别比较①-③小题中前后两个值的大小。用A、B、C、D表示前者和后者的关系。
①N和Ne的原子半径
A.大于 B.小于 C.等于 D.不能肯定
②F2和Br2的沸点
A.大于 B.小于 C.等于 D.不能肯定
③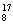 O和
O和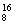 O的原子的核外电子数
O的原子的核外电子数
A.大于 B.小于 C.等于 D.不能肯定
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com