
21.答案:B
解析:此题考查共价键的极性和分子的极性。A中,CO2结构为O==C==O,H2S为
 所以都含极性键,但H2S是极性分子。
所以都含极性键,但H2S是极性分子。
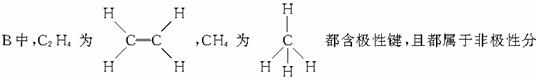 子。故B为答案。C中,Cl2不含极性键;D中NH3为极性分子都不合题意。
子。故B为答案。C中,Cl2不含极性键;D中NH3为极性分子都不合题意。
20.答案:A
解析:CO2的电子式应为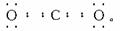
19.答案:AD
解析:如NaOH这样的离子化合物既含有离子键,又含有共价键。
18.答案:B
解析:以共价键形成的分子或离子中,如果能用电子式表示其结构,则每个原子的最外层必满足8电子稳定结构(氢满足2电子稳定结构)。
17.答案:BC
解析:同主族金属元素的原子半径越大,构成金属晶体的金属键越弱,则熔点越低;稀有气体为单原子分子构成的分子晶体,其相对分子质量随原子序数增大而增大,则熔沸点增高;分子间作用力越弱,分子晶体的熔点越低;同周期元素的原子半径是随原子序数增大从左到右逐渐减小,失电子能力逐渐减弱,得电子能力逐渐增强。
16.答案:A

解析:光气的电子式为: 因此分子中每个原子都能满足8电子
结构。SF6中一个硫原子形成6对共用电子对,故S不能满足8电子结构;XeF2中,氙原子成键前已满足8电子结构,成键后又形成两对共用电子对,故不能满足8电子结构;BF3分子中,B原子与F原子只形成了三对共用电子对,达不到8电子结构。
15.答案:C
解析:本题考查了化学式的含义。在四大类晶体中,除了分子晶体中含有独立的分子以外,其余几种晶体都找不到独立的分子,此时化学式仅表示物质中原子的最简组成。
14.答案:BD
解析:分子中的原子是否满足8电子结构取决于两个因素:一是该中性原子的最外层电子数;二是该原子在分子中形成的共价键数目。如果二者之和为8,则满足8电子结构。
13.答案:A
解析:金属晶体是由金属阳离子和自由电子构成的,不存在阴离子;金属钨的熔点高于原子晶体硅的熔点;分子晶体碘常温下为固态,而汞为液态。
12.答案:D
解析:A中N2的电子式书写不规范,正确的应为: :N┇┇N:;共价化合物中不能写电荷符号,故C错;复杂的离子的电子式必须有[ ]且要写出电荷符号。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com