
4、(1)不同,1 mol 二甲醚与乙醇燃烧所需要的O2、生成的CO2、H2O的量完全相同。但二甲醚与乙醇结构不同,1 mol二甲醚与乙醇中所含的化学键的数目相同,种类不同,导致化学键断裂所需能量不同。(2)3CO+3H2 = CH3OCH3+CO2 或 2CO+4H2 = CH3OCH3+H2O。 (3)①减小; ②12(x+y)。
设问方式多角度
4、二甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效,具有优良的环保性能。四川是利用天然气生产二甲醚的重要基地之一。
请填写下列空白:
(1)相同条件下,二甲醚与乙醇的燃烧热 (填“相同”或“不同”),理由是 。
(2)二甲醚可由合成气(CO+H2)在一定条件下制得。用合成气制二甲醚时,还产生了一种可参与大气循环的无机化合物,该反应的化学方程式可能是:____________________________________。
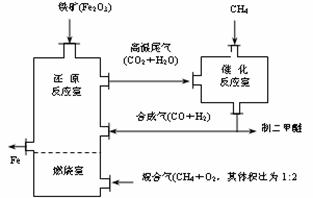
(3)制备二甲醚的合成气可由甲烷与水蒸气或二氧化碳经高温催化反应制得。合成气除制二甲醚外,还可用于冶炼金属,用它冶炼铁的生产过程可示意如下:
①在催化反应室中进行的反应均为可逆反应,增大体系的压强对甲烷转化率的影响是_________(填“增大”、“减小”或“不变”)。
②在上述炼铁过程的某时间段内,若有x m3(标准状况)的甲烷进入燃烧室中充分燃烧,还原反应室有5y kg(即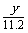 ×103 mol)铁生成,假设燃烧室与还原反应室产生的高温尾气全部进入催化反应室,则这些高温尾气在理论上可产生合成气_________m3(标准状况)。
×103 mol)铁生成,假设燃烧室与还原反应室产生的高温尾气全部进入催化反应室,则这些高温尾气在理论上可产生合成气_________m3(标准状况)。
3、答案..(1)CuO+2H+=Cu2++H2O,Fe2O3+6H+=2Fe3++3H2O,Cu+2Fe3++2Fe2++Cu2+
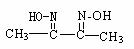 (2)4Fe2++O2+4H+=4Fe3++2H2O
(2)4Fe2++O2+4H+=4Fe3++2H2O
(3)n3=n1+n2-2
(4)4OH- -4e-=2H2O+O2 (5)B(6)A
3、现代社会中铜在电气、交通、机械和冶金、能源及石化工业、高科技等领域有广泛的应用。某铜矿石含氧化铜、氧化亚铜、三氧化二铁和脉石(Si02) ,现采用酸浸法从矿石中提取铜,其工艺流程图如下。其中铜的萃取(铜从水层进人有机层的过程)和反萃取(铜从有机层进人水层的过程)是现代湿法炼铜的重要工艺手段。
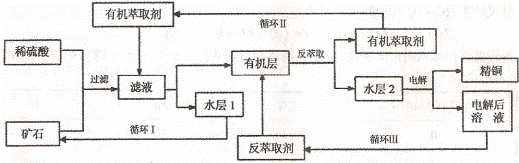 已知:①Cu2O+2H+=Cu2++Cu +
H2O;②当矿石中三氧化二铁含量太低时,可用硫酸和硫酸铁的混合液浸出铜;③反萃取后的水层2是硫酸铜溶液。回答下列问题:
已知:①Cu2O+2H+=Cu2++Cu +
H2O;②当矿石中三氧化二铁含量太低时,可用硫酸和硫酸铁的混合液浸出铜;③反萃取后的水层2是硫酸铜溶液。回答下列问题:
(1)矿石用稀硫酸处理过程中发生反应的离子方程式为:Cu2O+2H+=Cu2++Cu + H2O
、 (写其中2个各2分)
(2)“循环I”经多次循环后的水层1不能继续循环使用,但可分离出一种重要的硫酸盐晶体.若水层1暴露在空气中一段时间后,可以得到另一种重要的硫酸盐,写出水层l暴露在空气中发生反应的离子方程式 。2分
 (3)“循环n”中萃取剂是一类称作为肟类的有机化合物,如N一510、N一530等。
(3)“循环n”中萃取剂是一类称作为肟类的有机化合物,如N一510、N一530等。
某肟类化合物A的分子结构中仅含n1个-CH3、n2个-OH和n3个 三种基团,
无环状结构,三种基团的数目关系为n3= 。2分若A的相对分子质量为116,上述基团连接时碳原子跟碳原子相连,则A的结构简式是 1分
(4)写出电解过程中阳极(惰性电极)发生反应的电极反应式 1分
(5)该工艺最大亮点是它符合下列原理 。1分
A.化学平衡 B.绿色化学 C.质量守恒 D.能量守恒
E.相似相溶 F.酸碱中和 G.氧化还原反应
(6)铜、银、金是人类认识最早的三种金属,因为很早就被人们用作钱币,因而有“货币金属”之称。由于铁的金属性比铜、银、金强,相对而言,人类认识铁稍晚。某研究性学习小组为了证明铁的金属活动性比铜强,他设计了如下方案:①铁片置于硫酸铜溶液中有铜析出;②铁、铜和氯气反应分别生成FeCl3和CuCl2;③足量的铁粉和铜粉和浓硫酸反应生成FeSO4和CuSO4;④铜片置于FeCl3溶液中铜片逐渐溶解;⑤把铁片和铜片置于盛有稀硫酸的烧杯中,交用导线连接,铁片上无气泡产生,而铜片上有气泡产生;⑥把铁片和铜片置于盛有浓硝酸的烧杯中,并用导线连接,铁片上有气泡产生,而铜片上无气泡产生。以上设计合理的有 。1分
A.两种方案 B.三种方案 C.四种方案 D.五种方案
2、答案.(1)温度较低(2分)
(2)2NaCl + 2H2O 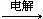 2NaOH + H2↑
+ Cl2↑(2分)
2NaOH + H2↑
+ Cl2↑(2分)
(3)Fe元素的化合价显+6价,易得电子(2分)
(4)10 mol/L(2分)
(5)AC(2分)
(6)KNO3 KCl, KNO3可用于化肥,炸药等(合理就给分)(2分)
2、高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下:
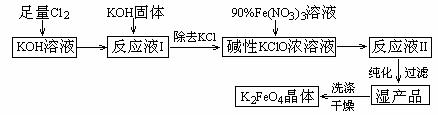
已知:① 2KOH + Cl2 → KCl + KClO + H2O(条件:温度较低)
② 6KOH + 3Cl2 → 5KCl + KClO3 + 3H2O(条件:温度较高)
③ 2Fe(NO3)3 + 2KClO + 10KOH → 2K2FeO4 + 6KNO3 + 3KCl + 5H2O
回答下列问题:
(1)该生产工艺应在 (填“温度较高”或“温度较低”)的情况下进行;
(2)写出工业上制取Cl2的化学方程式 ;
(3)K2FeO4具有强氧化性的原因 ;
(4)配制KOH溶液时,是在每100 mL水中溶解61.6 g KOH固体(该溶液的密度为1.47 g/mL),它的物质的量浓度为 ;
(5)在“反应液I”中加KOH固体的目的是 :
A.与“反应液I”中过量的Cl2继续反应,生成更多的KClO
B.KOH固体溶解时会放出较多的热量,有利于提高反应速率
C.为下一步反应提供反应物
D.使副产物KClO3转化为 KClO
(6)从“反应液II”中分离出K2FeO4后,会有副产品 (写化学式),它们都是重要的化工产品,具体说出其中一种物质的用途 。
1、(1) MnSO4 (1分)
(2)增大溶液的pH,使Fe3+和 Al3+生成沉淀; (1分)
使形成胶体的氢氧化铝和氢氧化铁也生成沉淀;(1分) H2SO4 (1分)
(3) Fe2O3、Al2O3、S (各1分) (4)纯碱 、H2SO4 (各1分) (5)降温结晶 (1分) (6)1.03(或1)(2分)
1、某工厂用软锰矿(含MnO2约70%及Al2O3)和闪锌矿(含ZnS约80%及FeS)
共同生产MnO2和Zn(干电池原料):
|
 ② IV中的电解反应式为MnSO4+ZnSO4+2H2O MnO2+
Zn+2H2SO4。
② IV中的电解反应式为MnSO4+ZnSO4+2H2O MnO2+
Zn+2H2SO4。
(1)A中属于还原产物的是__________
______。(1分)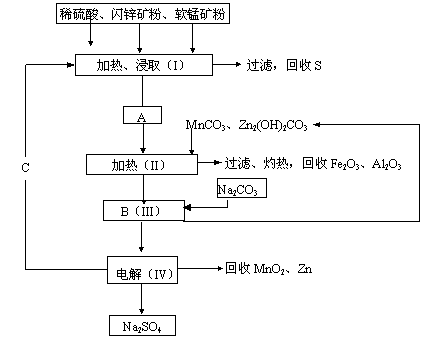
(2)MnCO3、Zn2(OH)2CO3的作用是 ;(1分)II需要加热的原因是 (1分);C的化学式是________________。(1分)
(3)该生产中除得到MnO2和Zn以外,还可得到的副产品是_______________________。(3分)
(4)如果不考虑生产中的损耗,除矿石外,需购买的化工原料是___________。(2分)
(5)要从Na2SO4溶液中得到芒硝(Na2SO4·10H2O),需进行的操作有蒸发浓缩、
________、过滤、洗涤、干燥等。(1分)
(6)从生产MnO2和Zn的角度计算,软锰矿和闪锌矿的质量比大约是______。(2分)
28、 (1)C(H2SO4)=0.0400/0.010=4.0(mol•L-1)
C(HNO3)=(0.14-0.080)/0.010=6.0(mol•L-1)
(2)340mL
27、 9 ; 27
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com