
19.(14分)巨豆三烯酮(F)是一种重要的香料,其合成路线如下:
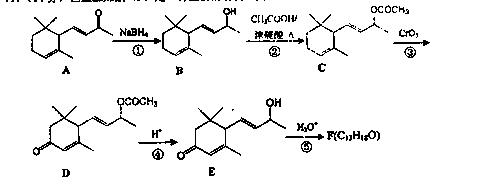
(1)化合物C含有的官能团的名称为 。
(2)化合物F的结构简式是 。
(3)在上述转化过程中,步骤②的目的是 ,写出步骤②的化学方程式 。
(4)写出符合下列条件的D的一种同分异构体的结构简式 。
a.属于芳香族化合物;
b.核磁共振氢谱显示,分子中有4种化学环境不同的氢原子;
c.1mol该物质最多可消耗2molNaOH
d.能发生银镜反应。
(5)兔耳草醛(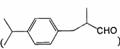 )也是一种重要的香料,主要用于食品、化妆品等工业中。请设计合理方案,以对异丙基苯甲醛(
)也是一种重要的香料,主要用于食品、化妆品等工业中。请设计合理方案,以对异丙基苯甲醛(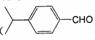 )和丙醛为原料合成兔耳草醛(用合成路线流程图表示,并注明反应条件)。
)和丙醛为原料合成兔耳草醛(用合成路线流程图表示,并注明反应条件)。
提示:①2CH3CHO CH3CH(OH)CH2CHO
CH3CH(OH)CH2CHO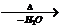 CH3CH=CHCHO
CH3CH=CHCHO
②合成过程中无机试剂任选;
③合成路线流程图示例如下:
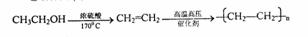
。
18.(12分)硫酸铜是一种重要的化工原料,工业上常用硫酸为原料来制备硫酸铜。
(1)工业上生产硫酸过程中,焙烧硫铁矿时产生的废渣是一种二次资源。
①为了从废渣中磁选获得品位合格的铁精矿,高温下利用CO使弱磁性Fe2O3转化为强磁性Fe3O4。写出该反应的化学方程式 ;实验发现:CO太多或太少都会导致磁铁矿产率降低,原因是 。
②氯化焙烧工艺是将废渣用氯化钙水溶液调和、成球、高温焙烧,废渣中SiO2与CaCl2等在高温下反应放出HCl,HCl与金属氧化物等反应生成氯化物。反应生成的各金属氯化物以气态形式逸出,进而回收有色金属和回返氯化钙溶液。写出氯化焙烧工艺中生成HCl的化学方程式 。
(2)测定硫酸铜品体中结品水含量的实验步骤为:
步骤1:准确称量一个洁净、干燥的坩埚;
步骤2:将一定量的硫酸铜晶体试样研细后,放入坩埚中称重
步骤3:将盛有试样的坩埚加热,待晶体变成白色粉末时,停止加热;
步骤4:将步骤3中的坩埚放入干燥器,冷却至室温后,称重:
步骤5: ;
步骤6:根据实验数据计算硫酸铜晶体试样中结晶水的质量分数。
请完成实验步骤5。
(3)已知硫酸铜品体受热可以逐步失去结品水,温度升高还町以分解生成铜的氧化物。观取25.0g CuSO4·5H2O品体均匀受热,缓慢升温至1200℃并恒温1小时,实验测得固体残留率(剩余固体的质量/原始固体质量)与温度的关系如下图所示:

在110℃时所得固体的成分为 ;在1200℃并恒温1小时,反应所得气态产物除去水后,物质的量为 。(填字母)
A.0 mol B.0.1mol C.0.125mol D.大于0.125mol
17.(8分)
(1)已知:N2(g)+O2(g)=2NO(g); △H=+180.5 kJ·mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(g);△H=-905 kJ·mol-1
2H2(g)十O2(g)=2H2O(g):△H=--483.6 kJ·mol-1
 则N2(g)+3H2(g)
2NH3(g)的△H=
。
则N2(g)+3H2(g)
2NH3(g)的△H=
。
(2)在一定条件下,将2mol N2与5mol H2混合于一个10 L的密闭容器中,反应情况如图1所示:
①求5min内的平均反应速率v(NH3) ;
②达到平衡时NH3的体积分数为 。
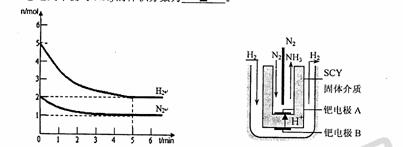
图1 图2 电解法合成氨装置
(3)近年来科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多品薄膜做电极,实现了高转化率的电解法合成氨(装置如图2)。钯电极A上发生的电极反应式是 。
16.(10分)氯化亚铜(CuCl)是白色粉末,不溶于水、乙醇及稀硫酸,熔点422℃,沸点1366,在空气中迅速被氧化成绿色,常用作有机合成工业中的催化剂。以粗盐水(含Ca2+、Mg2+、SO42-等杂质、Cu、稀硫酸、SO2等为原料合成CuCl的工艺如下:
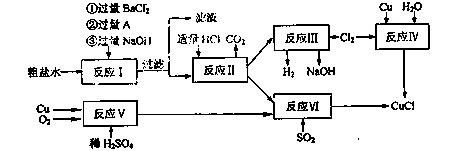
(1)A的化学式为 。
(2)写出反应V的化学方程式 。
(3)写出反应VI的离子方程式为 。
(4)本工艺中可以循环利用的物质是(刚化学式表示) 。
(5)反应VI后,过滤得到CuCl沉淀,用无水乙醇洗涤沉淀,在真空干燥机内于70℃干燥2小时,冷却,密封包装即得产品。于70℃真空干燥的目的是 。
15.(12分)纯净的过氧化钙(CaO2)难溶于水、乙醇,常温下较为稳定。CaO2·8H2O在0℃时稳定,加热至130℃时逐渐变为无水CaO2。在实验室可用钙盐制取CaO2·8H2O,再经脱水制得CaO2。其制备过程如下:

根据以上信息,同答下列问题:
(1)用上述方法制取CaO2·8H2O的化学方程式是 ;
(2)操作A的步骤为 ;
(3)检验“水洗”已经洗净的方法是 ;
(4)测定产品中CaO2的含量的实验步骤是(己知:I2+2S2O32-=2I-+S4O62-):
第一步:准确称取a g产品于锥形瓶中,加入适量蒸馏水和过量的b g KI品体,再滴入适量2 mol·L-1的H2SO4溶液,充分反应:
第二步:向上述锥形瓶中加入几滴淀粉溶液:
第三步:逐滴加入浓度为c mol·L-1的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液VmL。
①第三步反应完全时的现象为 ;
②产品中CaO2的质量分数为 (用字母表示);
③某同学经实验测得产品中CaO2的质量分数偏高,造成偏高的原因是(测定过程中由操作产生的误差忽略不计,用离子方程式表示) 。
14.相同温度下,容积相同的甲、乙、丙3个恒容密闭容器中发生可逆反应:
 2SO2(g)+O2(g) 2SO3(g);
2SO2(g)+O2(g) 2SO3(g); 。实验测得起始、平衡时的有关数据如下表:
。实验测得起始、平衡时的有关数据如下表:
|
容器 |
起始各物质的物质的量/mol |
达到平衡时体系能量的变化 |
|||
|
SO2 |
O2 |
SO3 |
Ar |
||
|
甲 |
2 |
1 |
0 |
0 |
放出热量:Q1 |
|
乙 |
1.8 |
0.9 |
0.2 |
0 |
放出热量:Q2 |
|
丙 |
1.8 |
0.9 |
0.2 |
0.1 |
放出热量:Q3 |
下列叙述正确的是 ( )
A.Q1=Q2=Q3=197 kJ
B.达到平衡时,丙容器中SO2的体积分数最大
C.甲、乙、丙3个容器中反应的平衡常数相等
D.若在上述条件下反应生成2molSO3(s)的反应热为△H1,则△H1<-197 kJ·mol-1
非选择题
13.J、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如右下表。已知:J元素最低负化合价的绝对值与其原子最外层电子数相等,M是地壳中含量最多的金属元素。下列说法错误的是 ( )
 A.J和氢组成的化合物分子中只含有极性共价键
A.J和氢组成的化合物分子中只含有极性共价键
B.工业上用电解M和T组成的化合物来制备M
C.R、T两元素的气态氢化物中,T的气态氢化物更稳定
D.J、M、R、T元素最高价氧化物对应的水化物中酸性最强的是HTO4
12.下列说法正确的是 ( )
A.分散系中分散质粒子的大小:Fe(OH)3悬浊液<Fe(OH)3胶体<FeCl3溶液
B.可利用反应2CO=2C+O2(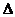 H>O、
H>O、 S<0)来消除CO污染
S<0)来消除CO污染
C.若弱酸HA的酸性强于弱酸HB,则相同物质的量浓度的钠盐溶液的碱性:NaA<NaB
D.除去Cu粉中混有的CuO,可将混合物加入稀硝酸中,充分反应后过滤、洗涤
10.人工合成的一种甜味剂的结构简式如右图所示下列说法正确的是 ( )
 A.分子式是C14H19N2O5
A.分子式是C14H19N2O5
B.该物质分子中含有2个手性碳原子
C.该物质能发生取代、加成、缩聚反应
D.1 mol该物质与NaOH溶液反应,最多
消耗2 mol NaOH
|
 11.如图装置(I)为一种可充电电池的示意图,其中的离子交换膜只允许K+通过,该电池放电、充电的化学方程式为:2K2S2+KI3
K2S4+3KI。装置(II)为电解池的示意图。当闭合开关K时,电极X附近溶液先变红。则闭合K时,下列说法正确的是 ( )
11.如图装置(I)为一种可充电电池的示意图,其中的离子交换膜只允许K+通过,该电池放电、充电的化学方程式为:2K2S2+KI3
K2S4+3KI。装置(II)为电解池的示意图。当闭合开关K时,电极X附近溶液先变红。则闭合K时,下列说法正确的是 ( )

A.K+从右到左通过离子交换膜
B.电极A上发生的反应为:3I--2e-=I3-
C.电极X上发生的反应为:2Cl--2e-=C12↑
D.当有0.1 mol K+通过离子交换膜,X电极上产生1.12 L气体(标准状况)
9.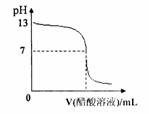 常温下,向10mL 0.1 mol·L-1NaOH溶液中逐滴加入0.1mol·L-1醋酸溶液,所得滴定曲线如右图所示。下列说法正确的是 ( )
常温下,向10mL 0.1 mol·L-1NaOH溶液中逐滴加入0.1mol·L-1醋酸溶液,所得滴定曲线如右图所示。下列说法正确的是 ( )
A.pH=7时,所加醋酸溶液的体积为10mL
B.pH<7时,溶液中c(CH3COO-)>c(Na+)
C.7<pH<13时,溶液中
c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D.继续滴加0.1 mol·L-1醋酸溶液,溶液pH可以变为1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com