
3、(2010·长沙模拟)某CuSO4、Fe2(SO4)3、H2SO4的混合溶液100mL,已知溶液中阳离子的浓度相同(不考虑水解),且SO42-的物质的量浓度为6mol·L-1,则此溶液最多溶解铁粉的质量为 ( )
A.5.6 g B.11.2g C.22.4g D.33.6g
[解析]选C。
2、(2010·哈尔滨模拟)某10mL溶液中HNO3浓度为2mol/L 、H2SO4浓度为4mol/L,现在加入56g铁粉,充分反应,产生的气体在标准状况下的体积为 ( )
A.0.448L B.4.48L C.0.672L D.0.896L
[解析]选C。根据题意可知n(H+)=0.1 mol、n(NO3-)=0.02 mol、n(Fe)=1 mol,
由氧化还原原理可知Fe先与 HNO3与反应,铁过量,硝酸全部转化为NO 0.02 mol ,根据反应的量化关系剩余0.02 mol的H+故产生的氢气为0.1 mol气体在标准状况下的总体积为0.672L。
1、(2010·南开中学模拟)已知2Fe2++Br2=2Fe3++2Br-。向100mlFeBr2溶液中通入标准状况下的Cl2 3.36L,充分反应后测得溶液中Cl-与Br-的物质的量浓度相等,则原FeBr2溶液的物质的量浓度为( )
A. 2mol/L B. 1mol/L C. 0.4mol/L D. 0.2mol/L
[解析]选A。利用原子守恒及电子守恒原理,可知2/3的Cl2与Fe2+反应,即
n(Fe2+)= 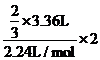 =0.2mol,所以c(FeBr2)=2mol/L。
=0.2mol,所以c(FeBr2)=2mol/L。
⒈分子结构鉴定的常用方法:
⑴化学方法:设计实验,利用特征反应鉴定出官能团,再制备它的衍生物进一步确认。
⑵物理方法:质谱、 、紫外光谱、 等。
⒉红外光谱:
原理: 在红外光谱图上的位置不同→含有 。
⒊核磁共振氢谱:
原理:不同化学环境中的 原子的核磁共振氢谱图上的位置不同,且吸收峰的面积(高度)与 原子数成正比→有机物中有几种不同类型的 原子及 原子数目。
试题枚举
[例1]某气态烃1L(标态)跟适量O2用电火花点燃,二者确好完全反应,生成物在1atm、
273℃时体积为xL ,冷却到标态时体积为yL,则该烃的分子式为 。
解析:本题用比例法求解。根据阿伏加德罗定律可知:同温、同压时气体的体积之比等于物质的量之比,气态烃1L(标态)与CO2 yL(标态)的条件相同,具有可比性得出该烃中含有y个C原子;而xL为H2O、CO2在1atm、273℃时体积,与烃的体积1L条件不同,要将体积转化为同一条件才可比较,可统一转化为1atm、273℃,此时气态烃的体积为2L,水的体积为x-2y,由此推出烃分子中H个数为x-2y。
答案:CyHx-2y
[例2] 下列是烃的衍生物中四个常见分子(溴乙烷、乙醇、乙醛、乙酸)的比例模型,其中表示乙醛分子的是( )

解析:根据题给条件, 4种分子中均只有2个C原子,且均含有有-CH3,从图中可看出左边为-CH3,与-CH3相连的黑色原子为C原子,与该C原子相连的白色原子为H,黑色原子为O或Br,根据各原子的成键数目及特点,可推出四种物质:
A为乙酸,B为乙醇,C为溴乙烷,D为乙醛。
答案:D
[例3]烃A的蒸汽对N2 的相对密度为5.07,若A为链烃,其分子式为 其同分异构体中支链最多的一种异构体的名称是 若A为环烃,其分子式为 。
解析:商余法解题的步骤是:Mr÷12=x……y ,分子式为CxH y,在此基础上,可用
C~12H、CH4 ~O、2CH4 ~2O的式量相等进行替代,可得到多个符合题意的分子式。
但替代后所得分子式中H原子数不得超过C原子数的2n+2个。
本题中Mr(A)=5.07×28=142 , 142÷12=10……22 C10H22 ,用1个C替换12个
H可得另一符合题意的分子式:C11H10
答案:C10H22 2,2,3,3,4-三甲基戊烷或 2,2,3,4,4-三甲基戊烷 ,C11H10 。
[例4]两种气态烃以任意比例混合,在105 ℃时1 L该混合烃与9 L氧气混合,充分燃烧后恢复到原状态,所得气体体积仍是10 L。下列各组混合烃中不符合条件的是
A.CH4、C2H4 B.CH4、C3H6
C.C2H4、C3H4 D.C2H2、C3H6
解析:由题意T>100 ℃(水为气体)。而此状况下燃烧前后体积不变,则烃分子含氢原子数等于4。所以选B项;又两烃是以任意比例混合,则D项也应选。故此题选B、D。
答案:BD
[例5]质子核磁共振谱(PMR)是研究有机物结构的有力手段之一,在所研究的化合物分子中,每一结构中的等性氢原子在PMR谱中都给出了相应的峰(信号)。峰的强度与结
构中的H原子数成正比,例如乙酸分子的PMR谱中有两个信号峰,其强度比为3:1。现有某化学式为C3H6O2的有机物的PMR谱有三个峰,其强度比为3:2:1,则该有机物的结构简式不可能是( )
A.CH3CH2COOH B.CH3COOCH3
C.HCOOCH2CH3 D.CH3COCH2OH
简析:在PMR谱中,等性氢原子都给出了相应的峰(信号),峰的强度与结构中的H原
子数成正比。因此PMR谱有三个峰说明有三种化学环境不同的氢原子,而且其个数比为3:2:1。
答案:B
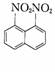
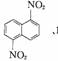 [例6]在一定条件下,萘可以被硝酸和硫酸的混合酸硝化生成二硝基物,它是1,5-二
[例6]在一定条件下,萘可以被硝酸和硫酸的混合酸硝化生成二硝基物,它是1,5-二
硝基萘 、1,8-二硝基萘 的混合物,后者可溶于质量分数大于
98%的硫酸,而前者不能。利用这一性质可将这两种异构体分离。将上述硝化产物加入适量98%的硫酸,充分搅拌,用耐酸漏斗过滤,欲从滤液中得到固体1,8-二硝基萘,应采用的方法是( )
A.蒸发浓缩结晶 B.向滤液中加水过滤
C.用碳酸钠溶液处理滤液 D.将滤液缓缓加入水中
简析:本题的关键是读懂题意,加入98%的硫酸后,1,5-二硝基萘不溶解,而1,8-二硝基萘溶于硫酸,这样得到了固体与液体的混合物,要用过滤的方法分离;分离后再将硫酸稀释,1,8-二硝基萘也析出,但只能将滤液缓缓加入水中,否则导致事故的发生。另外,不能将滤液用碳酸钠溶液处理,因该操作危险又浪费试剂。
答案:D
⒈最简式法:先由各元素的质量分数求出最简式 ,再由Mr求出分子式。(元素种类较少)
n(C)∶n(H)∶n(O)=ω(C)/12∶ω(H)/1∶ω(O)/16
⒉设n法:由元素X的ω(X)=n(X)·Ar(X)/Mr,得出分子中X的原子个数为:
n(X)=ω(X)·Mr/Ar(X)
⒊商余法:Mr÷12=x……y ,分子式为CxH y,然后用替换法写出可能的分子式
C-12H、O-CH4 如:Mr=58,58÷12=4…10,C4H 10,C3H6O,C2H2O2
⒋比例法:已知燃烧、反应前后的质量、物质的量、体积的定量关系
⒌通式法:根据题意先设有机物的分子式,再由题中条件立方程式(组)解答
⒍平均分子式法:C2.5H4
⒎其它方法:根据分子结构图、球棍模型或比例模型确定
⒈元素分析的目的是 ,
常用分析方法是
思考:如何进行元素C、H、O、N、X的测定?
⒉相对分子质量的测定
测定方法 ,该法是现代最快速、微量、精确测定相对分子质量的方法,该法测出的 的数值即为未知物的相对分子质量
简介:其它测定M的方法:标态密度法、相对密度法、设n法
思考:⑴分离与提纯的区别;⑵除杂三原则: 、 、 。
⒈蒸馏
⑴蒸馏法适用于 的有机混合物的分离。
⑵必须的玻璃仪器和用品
温度计水银球位于 ;加热前加素烧瓷片,目的是 。
⒉重结晶:
重结晶适用于 的有机混合物的分离与提纯。
对溶解度的要求:杂质 ,被提纯的有机物 。
操作步骤: → →
所需玻璃仪器有 。
⒊萃取:
萃取适用于 ;
萃取剂的要求 ;
仪器: ;
操作:振荡,静置分层,打开 口活塞,下层液体从 口放出,上层液体从 口倒出。
其它分离、提纯的方法还有(至少写3种) 。
24. (本小题满分10分)选修4-5:不等式选讲
对于任意实数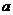
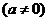 和
和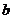 ,不等式
,不等式 恒成立,试求实数
恒成立,试求实数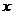 的取值范围.
的取值范围.
23. (本小题满分10分)选修4-4:坐标系与参数方程
在极坐标系下,已知圆O: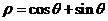 和直线
和直线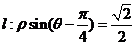 ,
,
(1)求圆O和直线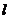 的直角坐标方程;
的直角坐标方程;
(2)当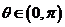 时,求直线
时,求直线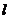 与圆O公共点的一个极坐标
与圆O公共点的一个极坐标
22.(本小题满分10分)
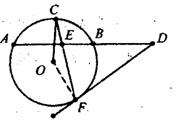
如图6,AB是⊙O的弦,C、F是⊙O上的点,OC垂直于弦AB,过F点作⊙O的切线交AB的延长线于D,连结CF交AB于E点。
(I)求证:DE2=DB·DA。
(II)若BE=1,DE=2AE,求DF的长。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com