
5.以推断的形式综合考查:
例5:已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。其中A、B、C是同一周期的非金属元素。化合物DC的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构。AC2为非极性分子。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。E的原子序数为24,ECl3能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2∶1,三个氯离子位于外界。请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的顺序为 。
(2)B的氢化物的分子空间构型是 。其中心原子采取 杂化。
(3)写出化合物AC2的电子式 ;一种由B、C组成的化合物与AC2互为等电子体,其化学式为 。
(4)E的核外电子排布式是
,ECl3形成的配 合物的化学式为 。
合物的化学式为 。
(5)B的最高价氧化物对应的水化物的稀溶液与D的单质反应时,B被还原到最低价,该反应的化学方程式是 。
 [解析]本题主要考查元素推导,涉及电离能,空间构型,杂化方式,电子式,等电子体,核外电子排布式以及氧化还原反应书写等知识点。A、B、C位于同一周期的三种非金属元素,且B、C在同族中氢化物的沸点最高,可以推断其中含有氢键,由此推测A、B、C位于第二周期的元素,又D的二价阳离子与C阴离子具有相同的结构,则说明D为Mg。由AC2为非极性分子,可推知为CO2,B元素则为N。24号的E则
[解析]本题主要考查元素推导,涉及电离能,空间构型,杂化方式,电子式,等电子体,核外电子排布式以及氧化还原反应书写等知识点。A、B、C位于同一周期的三种非金属元素,且B、C在同族中氢化物的沸点最高,可以推断其中含有氢键,由此推测A、B、C位于第二周期的元素,又D的二价阳离子与C阴离子具有相同的结构,则说明D为Mg。由AC2为非极性分子,可推知为CO2,B元素则为N。24号的E则 为Cr元素。(1)同一周期第一电离能具有增大的趋势,但由于N具有半充满结构,因而第一电离能最大,即为C<O<N;(2)B的氢化物即为NH3,中心氮原子采取sp3采化,由于有一对孤对电子,所以NH3应为三角锥形;(3)AC2即为二氧化碳,电子式中碳以二对电子分别和两边的氧共用;等子电子体的概念中要明确两点:原子数相等,价电子数相同。(4)24号Cr要注意核外电子的特殊性,即d电子为半充满的稳定结构排布,即[Ar]3d64s1。根据题目中所给信息,CrCl3的配体为NH3和H2O,两者之比为2:1,又总配体为6,则NH3为4个,H2O为2个,又Cl为外界,则配合物不难写出为[Cr(NH3)4(H2O)2]Cl3。(5)B的最高价氧化物对应水化物的化学式为HNO3,还原为最低价时应为-3价,即NH4NO3,D的单质即Mg,应被氧化成Mg
为Cr元素。(1)同一周期第一电离能具有增大的趋势,但由于N具有半充满结构,因而第一电离能最大,即为C<O<N;(2)B的氢化物即为NH3,中心氮原子采取sp3采化,由于有一对孤对电子,所以NH3应为三角锥形;(3)AC2即为二氧化碳,电子式中碳以二对电子分别和两边的氧共用;等子电子体的概念中要明确两点:原子数相等,价电子数相同。(4)24号Cr要注意核外电子的特殊性,即d电子为半充满的稳定结构排布,即[Ar]3d64s1。根据题目中所给信息,CrCl3的配体为NH3和H2O,两者之比为2:1,又总配体为6,则NH3为4个,H2O为2个,又Cl为外界,则配合物不难写出为[Cr(NH3)4(H2O)2]Cl3。(5)B的最高价氧化物对应水化物的化学式为HNO3,还原为最低价时应为-3价,即NH4NO3,D的单质即Mg,应被氧化成Mg 2+,然后根据化合价升除总值进行配平即可。
2+,然后根据化合价升除总值进行配平即可。
[答案](1)C<O<N (2)三角锥形 sp3 (3) N2O (4)1s22s22p63s23p63d54s1(或[Ar] 3d54s1) [Cr(NH3)4(H2O)2]Cl3 (5)4Mg+10HNO3=4Mg(NO3)2+NH4NO3+3H2O
[专题训练]
4.考查由性质或结构推断物质:
例4:四种短周期元素的性质或结构信息如下表。氢根据信息回答下列问题。
|
元素 |
A |
B |
 C C |
D |
|
性质 结构 信息 |
室温下单质呈粉末状固体,加热易熔化。单质在空气中燃烧,发出明亮的蓝紫色火焰。 |
单质常温、 常压下是气体,能溶于水。原子的M层有1个未成对的p电子 常压下是气体,能溶于水。原子的M层有1个未成对的p电子 |
单质质软、银白色固体、导电性强。单质在空气中燃烧发出黄色的火焰。 |
原子最外层电子层上s电子数等于p电子数。 单质为空间网状晶体,具有很高的熔、沸点。 |
⑴B元素在周期表中的位置 ,写出A原子的电子排布式 。
⑵写出C单质与水反应的化学方程式 。A与C形成的化合物溶于水后,溶液的pH 7(填“大于”、“等于”或“小于”)。
⑶D元素最 高价氧化物晶体的硬度
(填“大于”、“小”),其理由是
。
高价氧化物晶体的硬度
(填“大于”、“小”),其理由是
。
⑷A、B两元素非金属性较强的是(写元素符号) 。写出证明这一结论的一个实验事实 。
解析:根据题干提供的物质的性质或结构可进行推断,元素A,由“单质在空气中燃烧,发出明亮的蓝紫色火焰”可直接确定为硫元素。元素B,“原子的M层有1个未成对的p电子”则可能为[Ne]3s23p1或[Ne]3s23p4,又“单质常温、常压下是气体,能溶于水”,则应为Cl。元素C,根据物质的性质,“银白色、焰色为黄色”,则肯定为Na;元素D,“原子最外层电子层上s电子数等于p电子数”,则可能为1s22s22p2(C元素)或是1s22s22p62s22p2(Si元素),它们可以分别形成金刚石和晶体硅,且熔、沸点均很高,则均符合题意。能准确推断上述元素后,问题的回答并可顺利解决。
答案:⑴第三周期 ⅦA 1s22s22p63s23p4 ⑵2Na+2H2O=2NaOH+H2↑ 大于 ⑶大 SiO2是原子晶体(或 小 CO2是分子晶体)⑷Cl 高氯酸的酸性大于硫酸的酸性或氯化氢稳定比硫化氢强
3. 考查构成晶体微粒间的作用力及中心原子的杂化方式:
考查构成晶体微粒间的作用力及中心原子的杂化方式:
例3:在硼酸[B(OH)3]分子中,B原子与3个羟基相连,其晶体具有与石墨相似的层状结构。则分子中B原子杂化轨道的类型及同层分子间的主要作用力分别是:( )
A.sp,范德华力 B.sp2,范德华力 C.sp2,氢键 D.sp3,氢键
解析:由“B原子与3个羟基相连,其晶体具有与石墨相似的层状结构”知,B原子为sp2杂化,又因分子中存在羟基,故分子间存在氢键。
答案:C
1.考查元素周期律对物质性质递变的应用:
例1:下列说法正确的是 ( )
A.SiH4 比CH4 稳定
B.O2-半径比F―的小
C.Na和Cs属于第 IA 族元素, Cs 失电子能力比 Na 的强
D.P和As属于第 VA 族元素, H3PO4 酸性比 H3 AsO4的弱
 2.考查“位-构-性”的关系:
2.考查“位-构-性”的关系:
例2:元素X、Y和Z可结合形成化合物XYZ3;X、Y和Z的原子序数之和为26;Y和Z在同一周期。下列有关推测正确的是( )
A.XYZ3是一种可溶于水的酸,且X与Y可形成共价化合物XY
B.XYZ3是一种微溶于水的盐,且X与Z可形成离子化合物XZ
C.XYZ3是一种易溶于水的盐,且Y与Z可形成离子化合物YZ
D.XYZ3是一种离子化合物,且Y与Z可形成离子化合 物YZ3
物YZ3
30.(本小题12分)
已知函数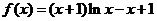
(I)求曲线在 处的切线方程;
处的切线方程;
(Ⅱ)若 ,求
,求 的取值范围;
的取值范围;
(Ⅲ)证明: 。
。
29.(本小题12分)
设定函数 ,且方程
,且方程 的两个根分别为1,4。
的两个根分别为1,4。
(Ⅰ)当a=3且曲线 过原点时,求
过原点时,求 的解析式;
的解析式;
(Ⅱ)若 在
在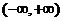 无极值点,求a的取值范围。
无极值点,求a的取值范围。
28.(本小题11分)
某种有奖销售的饮料,瓶盖内印有“奖励一瓶”或“谢谢购买”字样,购买一瓶若其瓶盖内印有“奖励一瓶”字样即为中奖,中奖概率为 .甲、乙、丙三位同学每人购买了一瓶该饮料。
.甲、乙、丙三位同学每人购买了一瓶该饮料。
(Ⅰ)求甲中奖且乙、丙都没有中奖的概率;
(Ⅱ)求中奖人数ξ的分布列及数学期望Eξ.
27.(本小题11分)
已知函数
(I)求函数 的最小正周期。
的最小正周期。
(II) 求函数 的最大值及
的最大值及 取最大值时x的集合。
取最大值时x的集合。
26.设函数f(x)=x- ,对任意x
,对任意x 恒成立,则实数m的取值范围是______ __.
恒成立,则实数m的取值范围是______ __.
25.已知函数f(x)= 若
若 ,则实数
,则实数 .
.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com