
4.某元素的电离能(电子伏特)如下表,此元素位于元素周期表的族数是
|
I1 |
I2 |
I3 |
I4 |
I5 |
I6 |
I7 |
|
14.5 |
29.6 |
47.4 |
77.5 |
97.9 |
551.9 |
666.8 |
A. ⅢA B.ⅣA C.ⅥA D.ⅤA E. ⅦA

 1(09全国Ⅱ卷). 某元素只存在两种天然同位素,且在自然界它们的含量相近,其相对原子质量为152.0,原子核外的电子数为63。下列叙述中错误的是
1(09全国Ⅱ卷). 某元素只存在两种天然同位素,且在自然界它们的含量相近,其相对原子质量为152.0,原子核外的电子数为63。下列叙述中错误的是

 A. 它是副族元素
B. 它是第六周期元素
A. 它是副族元素
B. 它是第六周期元素

 C. 它的原子核内有63个质子
D. 它的一种同位素的核内有89个中子
C. 它的原子核内有63个质子
D. 它的一种同位素的核内有89个中子
2.几种短周期元素的原子半径及主要化合价见下表:
|
元素符号 |
A |
B |
C |
D |
E |
|
原子半径(nm) |
0.160 |
0.080 |
X |
0.143 |
0.074 |
|
主要化合价 |
+2 |
+2 |
-2,+4,+6 |
+3 |
-2 |
则X可能的数值为
A.0.069 B.0.102 C.0.145 D.0.184
 3(09广东卷). 元素X、Y、Z原子序数之和为36,X、Y在同一周期,X+与Z2-具有相同的核外电子层结构。下列推测不正确的是
3(09广东卷). 元素X、Y、Z原子序数之和为36,X、Y在同一周期,X+与Z2-具有相同的核外电子层结构。下列推测不正确的是
 A.同周期元素中X的金属性最强
A.同周期元素中X的金属性最强
 B.原子半径X>Y,离子半径X+>Z2-
B.原子半径X>Y,离子半径X+>Z2-
 C.同族元素中Z的氢化物稳定性最高
C.同族元素中Z的氢化物稳定性最高
 D.同周期元素中Y的最高价含氧酸的酸性最强
D.同周期元素中Y的最高价含氧酸的酸性最强
5、元素金属性和非金属性强弱的判断方法
|
金 属 性 比 较 |
本质 |
原子越易失电子,金属性越强。 |
|
判 断 依 据 |
1.在金属活动顺序表中越靠前,金属性越强。 |
|
|
2.单质与水或非氧化性酸反应越剧烈,金属性越强。 |
||
|
3.单质还原性越强或离子氧化性越弱,金属性越强。 |
||
|
4.最高价氧化物对应水化物的碱性越强,金属性越强。 |
||
|
5.若xn++y=x+ym+
则y比x金属性强。 |
||
|
非 金 属 性 比 较 |
本质 |
原子越易得电子,非金属性越强。 |
|
判 断 方 法 |
1.与H2化合越易,气态氢化物越稳定,非金属性越强。 |
|
|
2.单质氧化性越强,阴离子还原性越弱,非金属性越强。 |
||
|
3.最高价氧化物的水化物酸性越强,非金属性越强。 |
||
|
4.An-+B=Bm-+A
则B比A非金属性强。 |
[典例分析]
例1(2010高考改编题)下列有关化学研究的正确说法是
A.酸性: B.碱性:
B.碱性:
C.从HF、HCl、HBr、HI酸性递增的事实,推出F、Cl、Br、I的非金属递增的规律
D.关于SiO2晶体网状结构的叙述正确的是存在四面体结构单元,O处于中心,Si处于4个顶角
答案:A B
解析:本题改变后侧重考查元素周期律重要的基本概念,规律,晶体结构。A项正确,一般元素非金属性越强,对应最高价氧化物的水化物的酸性越强;B正确,一般元素金属性越强,对应最高价氧化物的水化物的碱性越强。C.在以酸性强弱作为判断元素非金属性非金属性强弱依据时,是以最高价氧化物对应水化物的酸性强弱为判断依据的,故C项错误。D.二氧化硅是原子晶体,结构为空间网状,存在硅氧四面体结构,硅处于中心,氧处于4个顶角所以D项错误
例2(09广东卷1) 我国稀土资源丰富。下列有关稀土元素 与
与 的说法正确的是
的说法正确的是
A.  与
与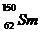 互为同位素
互为同位素
B.  与
与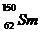 的质量数相同
的质量数相同
C.  与
与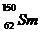 是同一种核素
是同一种核素
D.  与
与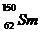 的核外电子数和中子数均为62
的核外电子数和中子数均为62
答案:A
解析: 由稀土元素 可知,该元素是含有相同质子不同中子的同种元素;其中
可知,该元素是含有相同质子不同中子的同种元素;其中 的质量数为144,中子数为82;
的质量数为144,中子数为82; 的质量数为150,中子数为88;故B、D项错;根据核素的定义“含有一定数目的质子和一定数目的中子”可知
的质量数为150,中子数为88;故B、D项错;根据核素的定义“含有一定数目的质子和一定数目的中子”可知 为两种核素,故C错。
为两种核素,故C错。
例3(2010广东理综卷,10)短周期金属元素甲~戊在元素周期表中的相对位置如右表所示,下面判断正确的是
 A.原子半径:
丙<丁<戊
B.金属性:甲>丙
A.原子半径:
丙<丁<戊
B.金属性:甲>丙
C.氢氧化物碱性:丙>丁>戊 D.最外层电子数:甲>乙
答案:C
解析:同周期元素原子半径是减小的,故A错;同主族元素金属性自上而下是增强的,故B错;同周期的元素的金属性越来越弱,故对应碱的碱性也是减弱的,C正确;同周期的最外层电子数越来越多,故D错。
例4(2010上海卷,20)几种短周期元素的原子半径及主要化合价如下表:
|
元素代号 |
X |
Y |
Z |
W |
|
原子半径/pm |
160 |
143 |
70 |
66 |
|
主要化合价 |
+2 |
+3 |
+3、-3、+5 |
-2 |
下列叙述正确的是
A.X、Y元素的金属性 X<Y
B.一定条件下,Z单质与W的常见单质直接生成2W2
C.Y的最高价氧化物对应的水化物能溶于稀氨水
D.一定条件下,W单质可以将Z单质从其氢化物中置换出来
答案:D
答案:此题考查了物质结构与元素周期律知识。根据题给数据,X、Y的化合价不同,但原子半径相差较小,可知两者位于同一周期相邻主族,故金属性X>Y,A错;根据Z、W的原子半径相差不大,化合价不同,且W只有负价,则其可能是O,Z是N,两者的单质直接生成NO,B错;据此判断可知X是Mg,Y是Al;Y的最高价氧化物的水化物是氢氧化铝,其不溶于氨水,C错;一定条件下,氧气可以和氨气反应生成水和氮气,D对。
例5(09北京卷).W、X、Y、Z均为短周期元素,W的最外层电子数与核外电子总数之比为7:17;X与W同主族;Y的原子序数是W和X的原子序数之和的一半;含Z元素的物质焰色反映为黄色。下列判断正确的是
A.金属性:Y Z
B 氢化物的沸点:
Z
B 氢化物的沸点:
C.离子的还原性: D 原子及离子半径:
D 原子及离子半径:
答案. B
[解析]本题考查物质结构和元素周期律。根据题设条件推知W为Cl、X为F、Y为Al、Z为Na。选项A,Al、Na 同周期,根据同周期元素递变规律,Na的金属性大于Al。选项B,HF分子间存在氢键,其沸点高于HCl。选项C,Cl―的还原性大于F―。选项D,Cl―的半径大于Na+、Al3+。
例6(2010山东卷,11)下列说法正确的是
A.形成离子键的阴阳离子间只存在静电吸引力
B.HF、HCL、HBr、HI的热稳定性和还原性从左到右依次减弱
C.第三周期非金属元素含氧酸的酸性从左到右依次增强
D.元素周期律是元素原子核外电子排布周期性变化的结果
答案:D
解析:离子键是阴阳离子通过静电作用形成的,静电作用包括静电吸引和静电排斥,故A错;因同驻足元素从上到下的非金属性减弱,故HF、HCL、HBr、HI的热稳定性依次减弱,但HF、HCL、HBr、HI的还原性依次增强,故B错;根据元素的非金属性越强,其对应的最高价汉阳算得酸性越强,C错‘因为没有指明是最高价含氧酸;元素周期律的根本原因是元素原子核外电子排布的周期性变化,D正确。
例7(2010浙江卷8). 有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期, Z、M同主族; X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的单质晶体熔点高、硬度大,是一种重要的半导体材料。下列说法中,正确的是
A. X、M两种元素只能形成X2M型化合物
B. 由于W、Z、M元素的氢气化物相对分子质量依次减小,所以其沸点依次降低
C. 元素Y、Z、W的单质晶体属于同种类型的晶体
D. 元素W和M的某些单质可作为水处理中的消毒剂
答案:D
解析:本题为元素周期律与周期表知识题。首先,运用周期表工具,结合周期规律,考虑位、构、性关系推断X、Y、Z、W、M分别是什么元素。在此基础上应用知识解决题给选项的问题。本题分析的要点或关键词是:短周期元素、同周期、同主族、相同的电子层结构、离子半径大小、单质晶体熔点硬度、半导体材料等。找到突破口:Y单质晶体熔点高硬度大、半导体材料,则Y是Si。根据X、Y、Z、W同周期,Z2- M2-知Z是S,M是O(Z、M同主族)。X+与M2-具有相同的电子层结构则X为Na。离子半径:Z2->W-,则W为Cl。整理一下:X\Y\Z\W\M分别是:Na\Si\S\Cl\O。
A、X、M两种元素能形成X2M和Na2O2两种化合物。B、W、Z、M元素的氢气化物分别为HCl\H2S\H2O,分子量减小,但由于水中存在氢键,沸点最高。C、Y、Z、W的单质分别为:Si\S\O2。分别属于原子晶体和分子晶体两种类型。D、W和M的单质Cl2\O3可作水处理剂。
例8(2010安徽卷,25)
X、Y、Z、W是元素周期表前四周期中的四种常见元素,其相关信息如下表:
|
元素 |
相关信息 |
|
X |
X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
|
Y |
常温常压下,Y单质是淡黄色固体,常在火山口附近沉积 |
|
Z |
Z和Y同周期,Z的电负性大于Y |
|
W |
W的一种核素的质量数为63,中子数为34 |
(1)Y位于元素周期表第 周期表 族,Y和Z的最高价氧化物对应的水化物的酸性较强的是 (写化学式)。
(2)XY2是一种常用的溶剂,XY2的分子中存在 个σ键。在H―Y、H―Z两种共价键中,键的极性较强的是 ,键长较长的是 。
(3)W的基态原子核外电子排布式是 。W2Y在空气中煅烧生成W2O的化学方程式是 。
(4)处理含XO、YO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质Y。
已知:
XO(g)+ O2(g)=XO2(g)
O2(g)=XO2(g) 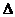 H=-283.0 kJ·mol-2
H=-283.0 kJ·mol-2
Y(g)+ O2(g)=YO2(g)
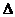 H=-296.0 kJ·mol-1
H=-296.0 kJ·mol-1
此反应的热化学方程式是 。
答案:(1)3 VIA HClO4
(2)2 H-Z H-Y
(3)[Ar]3d104s1 2Cu2S+3O2=2Cu2O+2SO2
(4)2CO(g)+SO2(g)=S(s)+2CO2 (g) △H=-270kJ/mol
解析:由表中可知,X为C Y为 S Z为 Cl W为Cu
例9(2010福建卷,23)
J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如右表;J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素。
(1)M的离子结构示意图为_____;元素T在周期表中位于第_____族。
(2)J和氢组成的化合物分子有6个原子,其结构简式为______。
(3)M和T形成的化合物在潮湿的空气中冒白色烟雾,反应的化学方程式为_____。
(4)L的最简单气态氢化物甲的水溶液显碱性。
①在微电子工业中,甲的水溶液可作刻蚀剂H2O2 的清除剂,所发生反应的产物不污染环境,其化学方程式为______。
②一定条件下,甲在固定体积的密闭容器中发生分解反应(△H>0)并达平衡后,仅改变下表中反应条件x,该平衡体系中随x递增y递减的是_______(选填序号)。
|
选项 |
a |
b |
c |
d |
|
x |
温度 |
温度 |
加入H2的物质的量 |
加入甲的物质的量 |
|
y |
甲的物质的量 |
平衡常数K |
甲的转化率 |
生成物物质的量总和 |
(5)由J、R形成的液态化合物JR2 0.2mol在O2中完全燃烧,生成两种气态氧化物,298K时放出热量215kJ。 该反应的热化学方程式为________。
解析:
(1) J元素最低负化合价的绝对值与其原子最外层电子数相等,可以判断J元素为碳元素;M是地壳中含量最多的金属元素为铝元素;根据J、R在周期表中的相对位置可以判断R为硫元
素,则T为氯元素,处于第三周期第七主族
(2)J和氢组成含有6个原子的分子为乙烯,其结构简式为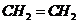
(3)M和T形成的化合物为 ,与水反应
,与水反应 ,其中氯化氢气体呈雾状
,其中氯化氢气体呈雾状
(4)①氨水与双氧水发生氧化还原反应:
生成无污染的氮气;
②甲在固体体积的密闭容器中发生分解反应 ,
, 表明正反应为吸热反应,升高温度,平衡朝着正方向移动,甲物质的量减少;加入
表明正反应为吸热反应,升高温度,平衡朝着正方向移动,甲物质的量减少;加入 的物质的量即增加生成物的浓度,平衡朝逆方向移动,甲的转化率减小
的物质的量即增加生成物的浓度,平衡朝逆方向移动,甲的转化率减小
(5)JR2为CS2,燃烧生成二氧化碳和二氧化硫,依题意可以很快的写出反应的热化学方程式

答案:(1)  ; ⅦA
; ⅦA
(2)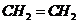
(3) ,
,
(4)①
②a和c;a或c
(5)

 例10(09安徽卷25)
例10(09安徽卷25)
 W、X、Y、Z是周期表前36号元素中的四种常见元素,其原子序数一次增大。W、Y的氧化物是导致酸雨的主要物质,X的基态原子核外有7个原子轨道填充了电子,Z能形成红色(或砖红色)的Z2O和黑色的ZO两种氧化物。
W、X、Y、Z是周期表前36号元素中的四种常见元素,其原子序数一次增大。W、Y的氧化物是导致酸雨的主要物质,X的基态原子核外有7个原子轨道填充了电子,Z能形成红色(或砖红色)的Z2O和黑色的ZO两种氧化物。
 (1)W位于元素周期表第_________周期第_________族。W的气态氢化物稳定性比
(1)W位于元素周期表第_________周期第_________族。W的气态氢化物稳定性比
 H2O(g)__________(填“强”或“弱”)。
H2O(g)__________(填“强”或“弱”)。
 (2)Y的基态原子核
外电子排布式是________,Y的第一电离能比X的__________(填“大”或“小”)。
(2)Y的基态原子核
外电子排布式是________,Y的第一电离能比X的__________(填“大”或“小”)。
 (3)Y的最高价氧化物对应水化物的浓溶液与Z的单质反应的化学方程式是
(3)Y的最高价氧化物对应水化物的浓溶液与Z的单质反应的化学方程式是
 _________________________________________________________________________。
_________________________________________________________________________。





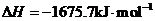
 X的单质和FeO反应的热化学方程式是_________________________________________。
X的单质和FeO反应的热化学方程式是_________________________________________。
 答案:(1)二 VA 弱
答案:(1)二 VA 弱
 (2)1s22s22p63s23p4 大
(2)1s22s22p63s23p4 大
 (3)Cu + 2H2SO4(浓)
(3)Cu + 2H2SO4(浓) CuSO4 + SO2↑+ 2H2O
CuSO4 + SO2↑+ 2H2O
 (4)3FeO(s) + 2Al(s)
(4)3FeO(s) + 2Al(s)  Al2O3(s) + 3Fe(s)
H=-859.7KJ/mol
Al2O3(s) + 3Fe(s)
H=-859.7KJ/mol
 解析:首先推出题中几种元素,W、Y的氧化物是导致酸雨的主要物质,在结合原子序数的大小可知,W是氮元素,Y是硫元素,X的基态原子核外有7个原子轨道填充了电子,根据基态原子核外电子所遵循的原则,可以写出电子排布式为:1s22s22p63s23p1,X为铝元素,Z能够形成红色的Z2O和黑色的ZO两种氧化物,推知Z为铜元素,两种氧化物分别为Cu2O和CuO。
解析:首先推出题中几种元素,W、Y的氧化物是导致酸雨的主要物质,在结合原子序数的大小可知,W是氮元素,Y是硫元素,X的基态原子核外有7个原子轨道填充了电子,根据基态原子核外电子所遵循的原则,可以写出电子排布式为:1s22s22p63s23p1,X为铝元素,Z能够形成红色的Z2O和黑色的ZO两种氧化物,推知Z为铜元素,两种氧化物分别为Cu2O和CuO。
[随堂检测]
4、简单微粒半径的比较方法
|
原 子 半 径 |
1.电子层数相同时,随原子序数递增,原子半径减小 例:rNa>rMg>rAl>rSi>rp>rs>rCl 2.最外层电子数相同时,随电子层数递增原子半径增大。 例:rLi<rNa<rk<rRb<rCs |
|
离 子 半 径 |
1.同种元素的离子半径:阴离子大于原子,原子大于阳离子,低价阳离子大于高价阳离子.例:rCl->rCl,rFe>rFe2+>rFe3+ 1. 电子层结构相同的离子,核电荷数越大,半径越小. 例:rO2->rF->rNa+>rMg2+>rAl3+ 2. 带相同电荷的离子,电子层越多,半径越大. 例:rLi+<rNa+<rK+<rRb+<rcs+;rO2-<rs2-<rse2-<rTe2- 3. 带电荷、电子层均不同的离子可选一种离子参照比较。 例:比较rk+与rMg2+可选rNa+为参照可知rk+>rNa+>rMg2+ |
3、同周期同主族元素递变规律
|
|
|
同周期(左→右) |
同主族(上→下) |
|
原子结构 |
核电荷数 |
逐渐增大 |
增大 |
|
电子层数 |
相同 |
增多 |
|
|
原子半径 |
逐渐减小 |
逐渐增大 |
|
|
|
化合价 |
最高正价由+1→+7负价数=8-族序数 |
最高正价和负价数均相同,最高正价数=族序数 |
|
元素的金属性和非金属性 |
金属性逐渐减弱,非金属性逐渐增强。 |
金属性逐渐增强,非金属性逐渐减弱。 |
|
|
单质的氧化性和还原性 |
氧化性逐渐增强,还原性逐渐减弱。 |
氧化性逐渐减弱,还原性逐渐增强。 |
|
|
最高价氧化物的水化物的酸碱性 |
酸性逐渐增强,碱性逐渐减弱。 |
酸性逐渐减弱,碱性逐渐增强。 |
|
|
气态氢化物的稳定性、还原性,水溶液的酸性。 |
稳定性逐渐增强,还原性逐渐减弱,酸性逐渐增强。 |
稳定性逐渐减弱,还原性逐渐增强,酸性逐渐减弱。 |
2、元素周期表
|
元素周期表的结构 |
位置与结构的关系 |
|||
|
周 期 |
|
周期序数 |
元素的种数 |
1.周期序数=原子核外电子层数 2.对同主族(nA族)元素 若n≤2,则该主族某一元素的原子序数与上一周期元素的原子序数的差值为上一周期的元素种数。 若n≥3,则该主族某一元素的原子序数与上一周期元素的原子序数的差值为该周期的元素种数。 |
|
短 周 期 |
第一周期 |
2 |
||
|
第二周期 |
8 |
|||
|
第三周期 |
8 |
|||
|
长 周 期 |
第四周期 |
18 |
||
|
第五周期 |
18 |
|||
|
第六周期 |
32 |
|||
|
第七周期 |
26(不完全周期) |
|||
|
族 |
主 族 |
ⅠA族- ⅦA族 |
由长周期元素和短周期元素共同构成的族。 |
最外层电子数=主族序数=价电子数 |
|
零 族 |
|
最外层电子数均为8个(He为2个除外) |
||
|
副 族 |
ⅠB族- ⅦB族 |
只由长周期元素构成的族 |
最外层电子数一般不等于族序数(第ⅠB族、ⅡB族除外) 最外层电子数只有1-7个。 |
|
|
第Ⅷ族 |
有三列元素 |
|
1、元素周期律
|
涵 义 |
元素性质随着元素原子序数的递增而呈周期性变化。 |
|
实 质 |
元素性质的周期性递变本质原因:核外电子排布周期性变化。 |
|
核外电 子排布 |
最外层电子数由1递增至8(若K层为最外层则由1递增至2)。 |
|
原子半径 |
原子半径由电子层数和核电荷数多少决定,同周期半径由大到小(稀有气体元素除外)呈周期性变化。 |
|
主要化合价 |
元素主要化合价由元素原子的最外层电子数决定,一般存在下列关系:最高正价数=最外层电子数;最高正价由+1递变到+7,从中部开始有负价,从-4递变至-1。(稀有气体元素化合价为零),
呈周期性变化。 |
|
元素及化合物的性质 |
同周期内的元素,电子层数相同,最外层电子数逐渐增多,核电荷数增加,原子核对外层电子引力渐强,使元素原子失电子渐难,得电子渐易,金属性渐弱,非金属性渐强,最高氧化物的水化物的碱性渐弱,酸性渐强,呈周期性变化。 |
4、核外电子排布
(1)电子运动的特征:高速,空间小,无确定轨迹。
描述方式:电子云。
(2)分层排布:
代号:K L M N O P Q……
层序:1 2 3 4 5 6 7……

电子离核渐远,能量逐渐升高
(3)排布规律:
a每层最多容纳2n2个电子(n表示第几层)。
b最外电子层不能超过8个,次外层不能超过18个,倒数第三层不能超过32个。
c遵循能量最低原理:电子首先排满能量低的电子层,然后再能量高的电子层;即先排满K层,再排L层,再排M层等。
以上三条规律不是孤立的,而是相互制约,必须同时满足。
3、相对原子质量
(1)原子的相对原子质量


(2)元素的相对原子质量:按各种天然同位素在该元素中原子个数百分数计算求得的平均相对原子质量。
其中: 是各种同位素的相对原子质量;
是各种同位素的相对原子质量; 是指各种同位素的天然原子百分比。若
是指各种同位素的天然原子百分比。若 是各种同位素的质量数,则计算的是近似相对原子质量,而它是最常用的。
是各种同位素的质量数,则计算的是近似相对原子质量,而它是最常用的。
2、核素与同位素
(1)核素:具有一定数目的质子和一定数目的中子的某一元素的一种原子叫做核素。
(2)同位素:具有相同质子数,而中子数不同的同一元素的各种原子互称同位素(限制的范围是原子)。即:同一元素的不同核素之间互称同位素。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com