
10. 下列说法不正确的是 ( )
A.对于吸热反应,反应物所具有的总能量总是低于生成物所具有的总能量
B.任何放热反应在常湿条件下一定能发生反应
C.在稀溶液中,酸跟碱发生中和反应生成1molH2O时的反应热叫做中和热
D.在101kPa,1mol物质完全燃烧生成稳定氧化物时所放出的热量就叫做该物质的燃烧热
[答案]D
9. 2008年北京奥运会所用火炬燃料为丙烷(C3H8),悉尼奥运会所用火炬燃料为65%丁烷(C4H10)和35%丙烷(C3H8),已知丙烷的燃烧热为:2221.5kJ·mol-1,正丁烷的燃烧热为:2878kJ·mol-1,异丁烷的烯烧热为:2869.6kJ·mol-1,下列有关说法正确的是( )
A.奥运火炬燃烧时的能量转化主要是化学能转变为热能
B.相同质量的正丁烷和丙烷分别完全燃烧,前者需要的氧气多,产生的热也多
C.正丁烷比异丁烷稳定
D.丙烷燃烧的热化学方程式为:C3H8+5O2==3CO2+4H2O;△H=-2221.5kJ·mol-1
[答案]A
8. 甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是( ) ①CH3OH(g)+H2O(g)=CO2(g)+3H2(g);△H=+49.0kJ·mol-1 ②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g);△H=-192.9kJ·mol-1 下列说法正确的是
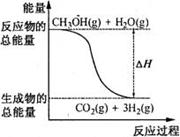 A.CH3OH的燃烧热为192.9kJ·mol-1
B.反应①中的能量变化如右图所示
C.CH3OH转变成H2的过程一定要吸收能量
D.根据②推知反应CH3OH(l)+1/2O2(g)=CO2(g)+2H2(g)
A.CH3OH的燃烧热为192.9kJ·mol-1
B.反应①中的能量变化如右图所示
C.CH3OH转变成H2的过程一定要吸收能量
D.根据②推知反应CH3OH(l)+1/2O2(g)=CO2(g)+2H2(g)
的△H>-192.9kJ·mol-1
[答案]D
7. 根据热化学方程式:S(g)+O2(g)=SO2(g);△H= -297.23kJ/mol。下列说法中正确的是 ( )
A.S(g)+O2(g)=SO2(l); |△H|>297. 3kJ/mol
B.S(g)+O2(g)=SO2(l);|△H|<297. 3kJ/mol
C.1mol SO2的键能总和小于1mol S和1mol O2键能之和
D.1mol SO2的键能总和等于1mol S和1mol O2键能之和
[答案]A
6. 在25℃、1.01×105Pa下,将22 g CO2通入1 mol·L-1NaOH溶液750mL中充分反应,测得反应放出x kJ热量。在该条件上,1 mol CO2通入2 mol·L-1NaOH溶液1 L中充分反应放出y kJ热量。则CO2与NaOH溶液反应生成NaHCO3的热化学方程式是 ( )
A.CO2(g)+NaOH(aq) === NaHCO3(aq);△H=-(2y-x) kJ·mol-1
B.CO2(g)+NaOH(aq) === NaHCO3(aq);△H=-(2x-y) kJ·mol-1
C.CO2(g)+NaOH(aq) === NaHCO3(aq);△H=-(4x-y) kJ·mol-1
D.2CO2(g)+NaOH(1) === NaHCO3(1);△H=-(8x-2y) kJ·mol-1
[答案]C
5. 下列有关热化学方程式的叙述正确的是 ( )
A.已知2H2(g)+O2(g)===2H2O(g);△H=-483.6 kJ/mol,则氢气的燃烧热为241.8 kJ
B.已知C(石墨,s)=== C(金刚石,s);△H>0,则金刚石比石墨稳定
C.含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则该反应中和热的热化学方程式为:NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l);△H=-57.4 kJ/mol
D.已知2C(s)+2O2(g)==2CO2(g);△H1。2C(s)+O2(g)=2CO(g);△H2。则△H1>△H2
[答案]C
4. 已知下列反应的热化学方程式为:⑴C(s)+O2(g)=CO2(g) ;ΔH 1=-393.5kJ/mol
⑵CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ;ΔH 2=-870.3kJ/mol
⑶H2(g)+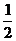 O2(g)=H2O(l) ;ΔH 3=-285.8kJ/mol
O2(g)=H2O(l) ;ΔH 3=-285.8kJ/mol
则反应2C(s)+2H2(g)+O2(g)=CH3COOH(l) 的ΔH 为
A.488.3 kJ/mol B.-488.3 kJ/mol C.-244.15 kJ/mol D.244.15 kJ/mol
[答案]B
3. 下列热化学方程式中△H的绝对值能表示可燃物的燃烧热的是 A.1/2H2(g)+ 1/2Cl2(g)= HCl(g);△H=-92.3kJ/mol
B.CH4(g)+ 2O2(g)= CO2(g)+2H2O(g);△H=-802.3kJ/mol
C.2H2(g)+ O2(g)= 2H2O(l);△H=-571.6kJ/mol
D.CO(g)+ 1/2O2(g)= CO2(g);△H=-283kJ/mol
[答案]D
2. 下列有关热化学方程式的叙述正确的是 ( )
A.已知2H2(g)+O2(g) == 2H2O(l);△H=-571.6kJ·mol-1,则氢气的燃烧热为285.8kJ·mol-1
B.已知C(石墨,s)== C(金刚石,s);△H>0,则金刚石比石墨稳定
C.含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为:
NaOH(aq)+CH3COOH(aq) == CH3COONa(aq) + H2O(l) △H =-57.4kJ·mol-1
D.已知2C(s)+2O2(g)=2CO2(g) △H1;2C(s)+O2(g)=2CO(g) △H2,则△H1>△H2
[答案]A
1. 下列说法或表示方法正确的是
A.反应物的总能量低于生成物的总能量时,该反应一定不能发生
B.强酸跟强碱反应放出的热量就是中和热
C.由石墨比金刚石稳定可知: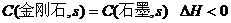
D.在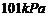 、
、 时,
时,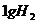 完全燃烧生成气态水,放出
完全燃烧生成气态水,放出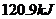 热量,则氢气的燃烧热为241.8
热量,则氢气的燃烧热为241.8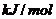
[答案]C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com