
20. 工业上制备纯硅反应的热化学方程式如下: SiCl4(g)+2H2(g)===Si(s)+4HCl(g);△H=+QkJ·mol-1(Q>0)某温度、压强下,将一定量的反应物通入密闭容器进行以上的反应(此条件下为可逆反应),下列叙述正确的是( )
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1mol,则达到平衡时,吸收热量为QkJ
C.反应至4min时,若HCl的浓度为0.12mol·L-1,则H2的反应速率为0.03mol/(L·min)
D.当反应吸收热量为0.025QkJ时,生成的HCl通入100mL1mol·L-1的NaOH恰好反应
[答案]D
19. 以NA代表阿伏加德罗常数,有关反应( )
C2H2(g)+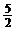 O2(g)→2CO2(g)+H2O(l);ΔH= -1300kJ/mol
O2(g)→2CO2(g)+H2O(l);ΔH= -1300kJ/mol
下列关于热化学方程式的说法正确的是
A.有5NA个电子转移时,该反应放出1300kJ的能量
B.有NA个水分子生成且为液体时,吸收1300kJ的能量
C.有4NA个碳氧共用电子对生成时,放出1300kJ的能量
D.有8NA个碳氧共用电子对生成时,放出1300kJ的能量
[答案]D
18. 下列说法正确的是 ( )
A.标准状况下,11.2LHCl中含 6.02×1023个离子
B.△H<0,△S>0的化学反应一定能自发进行
C.pH=5的盐酸,稀释1000倍后,溶液pH约为8
D.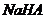 溶液
溶液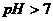 ,则
,则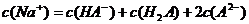
[答案]B
17. 下列热化学方程式中的ΔH能表示对应可燃物质燃烧热的是( )
A.2 CO(g) + O2(g) = 2 CO2(g);ΔH = -566 KJ·mol-1
B.CH4(g) + 2 O2(g) =CO2(g) + 2 H2O(l);ΔH = -890 KJ·mol-1
C.2 H2(g) + O2(g) = 2 H2O(l);ΔH = -571.6 KJ·mol-1
D.H2(g) + Cl2(g) = 2 HCl(g) ;ΔH = -184.6 KJ·mol-1
[答案]B
16. 下列表述中正确的是 ( )
A.任何能使熵值减小的过程都能自发进行
B.已知热化学方程式2SO2 (g)+O2 (g)
 2SO3 (g);△H=-QkJ·mol-1(Q>0),
2SO3 (g);△H=-QkJ·mol-1(Q>0),
则将2mol SO2(g)和1mol O2(g)置于一密闭容器中充分反应后放出QkJ的热量
C.在Na2SO4溶液中加入过量的BaCl2后,溶液中不存在SO42-
D.1mol NaOH分别和1mol CH3COOH、1molHNO3反应,后者比前者△H小
[答案]D
15. 下列说法或表示法正确的是( )
A.测定HCl和NaOH的中和热时,每次实验均应测量三个温度,即盐酸起始温度、NaOH起始温度和反应后的终止温度
B.由“C(石墨)-→C(金刚石);△H= +119 kJ/mol ”可知金刚石比石墨稳定
C.在稀溶液中: H++OH-=H2O;△H=-57.3kJ/mol,若将含0.5molH2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热量大于57.3kJ
D.在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l);△H= +285.8kJ/mol
[答案]AC
14. 有关键能数据如表
|
化学键 |
Si-O |
O=O |
Si-Si |
|
键能/kJ·mol-1 |
X |
498.8 |
176 |
晶体硅在氧气中燃烧的热化学方程式为Si(s)+O2(g)=SiO2(s);△H = -989.2/kJ·mol-1,则X的值为 ( )
A.423.3 B.460 C.832 D.920
[答案]B
13. 燃烧1g液态有机物,只生成0.05molCO2气体和1.2g液态水,且放出热量33.63kJ,该有机物的蒸汽对H2的相对密度为30,则该有机物燃烧的热化学方程式为( )
A.C3H8O(l)+9/2O2(g)=3CO2(g)+4H2O(l); △H=-2017.8kJ/mol
B.C3H8 (l)+5O2(g)=3CO2(g)+4H2O(l); △H=-33.63kJ/mol
C.C3H8(l)+5O2(g)=3CO2(g)+4H2O(l); △H=-1479.4kJ/mol
D.C3H8O(l)+9/2O2(g)=3CO2(g)+4H2O(g); △H=-2017.8kJmol
[答案]A
12. 一定条件下,用甲烷可以消除氮氧化物(NOx)的污染。已知:
① CH4 (g)+4NO2 (g)=4NO (g) +CO2 (g)+2H2O (g) ;△H=―574 kJ·mol-1
② CH4 (g)+4NO (g)=2N2 (g)+CO2 (g)+2H2O (g) ;△H=―1160 kJ·mol一1。
下列选项正确的是( )
A.CH4 (g)+2NO2 (g)= N2 (g)+CO2 (g)+2H2O (l) ;△H=―867 kJ·mol-1
B.若0.2 mol CH4还原NO2至N2,在上述条件下放出的热量为173.4 kJ
C.1molCH4催化还原NOx为N2的过程中,若x=1.6,则转移的电子为3.2 mol
D.若用标准状况下2.24L CH4还原NO2至N2,整个过程中转移的电子为0.8 mol
[答案]BD
11. 二甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能;二甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455 kJ/mol;工业上用合成气(CO、H2)直接或间接制取二甲醚。下列叙述正确的是( )
A.二甲醚分子只含有极性共价键
B.二甲醚为可再生能源
C.以二甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。该电池中负极上的电极反应式是CH3OCH3-12e-+12OH-=2CO2+8H2O
D.二甲醚燃烧的热化学方程式表示为CH3OCH3(g)+3O2(g)→2CO2(g)+3H2O(g);ΔH=-1455 kJ/mol
[答案]A
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com