
25.(10分)
用50 mL 0.50mol·L-1盐酸与50 mL 0.55 mol·L-1 NaOH溶液,在如图所示的装置中 进行中和反应,测定强酸与强碱反应的反应热。
进行中和反应,测定强酸与强碱反应的反应热。
|
|
起始温度t1/℃ |
终止温度t2/℃ |
温度差 (t2-t1)/℃ |
||
 |
 |
平均值 |
|||
|
1 |
25.5 |
25.0 |
25.25 |
28.5 |
3.25 |
|
2 |
24.5 |
24.2 |
24.45 |
27.6 |
3.15 |
|
3 |
25.0 |
24.5 |
24.75 |
26.5 |
1.75 |
(1)在该实验中,量取50 mL盐酸或NaOH溶液,需要用到的玻璃仪是 ;
(2)装置中大、小烧杯之间填满碎泡沫塑料的目的是 ;
(3)某同学实验记录的数据如上表所示,其中记录的终止温度是指 温度;
(4)计算该实验发生中和反应时放出的热量为 kJ[中和后生成的溶液的比热容c=4.18 J·(g·℃)-1,稀溶液的密度都为1 g·cm-3];
(5)如果用50 mL 0.55 mol·L一的氨水(NH3·H2O)代替NaOH溶液进行上述实验,通过测得的反应热计算中和热,其中和热△H会偏大,其原因是 。
24.(15分)
工来合成氨与制备硝酸一般可连续生产,流程如下:
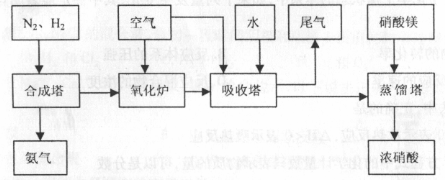
(1)工来生产时,制取氢气的一个反应为: ,
,
①t℃时,往l L密闭容器中充人0.2 mol CO和0.3 mol水蒸气,反应建立平衡后,体系中c(H2)=0.12 mol·L-1,该温度下此反应的平衡常数K= ;
②保持温度不变,向上述平衡体系中再加入0.1 mol CO,当反应重新建立平衡时,水蒸气的总转化率 (H2O)=
。
(H2O)=
。
|
T(K) |
T1 |
573 |
T2 |
|
K |
1.00×107 |
2.45×105 |
1.88×103 |
(2)合成塔中发生反应为:
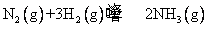

右表为不同温度下该反应的平衡常数。由此可推知,表中T1 573K(填“>”、“<”或“=”)。
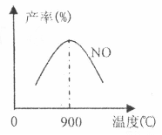
(3)NH3和O2在铂系催化剂作用下从145℃就开始反应:
4NH3+5O2 NO+6H2O AH=-905kJ·mol-1,不同温度下NO产率如图所示,温度高于900℃时,NO产率下降的原因
NO+6H2O AH=-905kJ·mol-1,不同温度下NO产率如图所示,温度高于900℃时,NO产率下降的原因
。
(4)吸收塔中反应为:3NO2+H2O 2HNO3+NO。从生产流程看,吸收塔中需要补充空气,其原因是
2HNO3+NO。从生产流程看,吸收塔中需要补充空气,其原因是
 (5)硝酸厂的尾气含有氮氧化物,不经处理直接排放将污染空气。目前科学家探索利用燃料气体中的甲烷将氮氧化物还原为氮气和水,其反应机理为:
(5)硝酸厂的尾气含有氮氧化物,不经处理直接排放将污染空气。目前科学家探索利用燃料气体中的甲烷将氮氧化物还原为氮气和水,其反应机理为:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)  H=-574kJ·mol-1。;
H=-574kJ·mol-1。;
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)  H=-1160 kJ·mol-1;
H=-1160 kJ·mol-1;
则甲烷直接将NO2还原为N2的热化学方程式为: 。
23.(12分)
W、X、Y、Z是原子序数依次增大的同一短周期元素,W是金属元素,X是地壳中含量最多的金属元素,且W、X的最高价氧化物的水化物相互反应生成盐和水;Y、Z是非金属元素,Y与W可形成离子化合物W2Y;G在Y的前一周期,其原子最外层比Y原子最外层少一个电子。
(1)X的原子结构示意图为 ;
(2)W、X的最高价氧化物的水化物相互反应的离子方程式为 ;
(3)工业上制取X单质的化学方程式为 ;
(4)G的气态氢化物与Y的最高价氧化物的水化物恰好反应生成的正盐溶液中,离子浓度由大到小的顺序为 ;在催化剂作用下,汽车尾气中G的氧化物GO与CO两种气体能相互反应转化为无污染、能参与大气循环的两种气体,若有33.6 L(已换算成标准状况)一氧化碳参加反应,转移的电子数为 mol;
(5)298K时,Z的最高价氧化物为无色液体,0.25 mol该物质与一定量水混合得到Z的最高价氧化物的水化物的稀溶液,并放出a kJ的热量,该反应的热化学方程式为
。
22.(7分)
将4 mol SO2与2 molO2放人4 L的密闭容器中,在一定条件下反应达到平衡:
 测得平衡时混合物总的物质的量为5 mol,求:
测得平衡时混合物总的物质的量为5 mol,求:
(1)平衡时各物质的物质的量浓度;
(2)该温度下的平衡常数;
(3)平衡时SO2的转化率。
B卷 (满分50分)
21.(10分)
(1)右图分别是温度计、量筒、滴定管的一部分,则:
①量筒应该是 (填字母,下同),读数为 mL;
②滴定管是 ,读数为 mL;
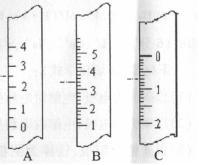 ③温度计是 ,读数是 ℃。
③温度计是 ,读数是 ℃。
(2)用已知浓度的盐酸滴定未知浓度的氢氧化钠溶液时,下列实验操作对测量结果有何影响(选填“偏高”、“偏低”或“无影响”)
①滴定前滴定管尖嘴有气泡,滴定后尖嘴气泡消失 ;
②中和滴定时,锥形瓶内有少量蒸馏水 ;
③酸式滴定管用蒸馏水洗后,未用标准液润洗
④滴定管终点读数时,仰视读取刻度线 。
20.(15分)
I.A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。
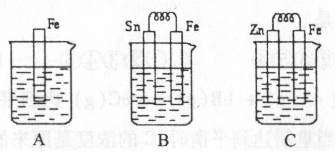
(1)A中反应的离子方程式为 ;
(2)B中Sn极的电极反应式为 ,Sn极附近溶液的pH (填“增大”、“减小”或“不变”);
(3)C中被腐蚀的金属是 ,总反应式为 ;
比较A、B、C中铁被腐蚀的速率,由快到慢的顺序是 。
II.现有常温下的6份溶液:①0.01 mol·L-1CH3COOH溶液;②0.01 mol·L-1HCl溶液;③pH=13的氨水;④pH=13的NaOH溶液;⑤0.01 mol· L-1CH3COOH溶液与pH=12的NaOH等体积混合后所得溶液;⑥0.01 mol·L-1HCI溶液与pH=12的NaOH溶液等体积混合所得溶液。
(1)其中水的电离程度最大的是 (选填序号,下同),水的电离程度相同的是 ;
(2)若将②、④混合后所得溶液pH=12,则消耗②、④溶液的体积之比为 ;
(3)将溶液同等稀释10倍后溶液的pH:③ ④,⑤ ⑥(选填“>”或“<”或“=”)。
19.(8分)
(1)AgNO3的水溶液呈 (填“酸”、“中”、“碱”)性,常温时的pH 7(填”>”或”=”或”<”),原因是(用离子方程式表示): ,实验室在配制AgNO3的溶液时为了抑制其水解,常将AgNO3固体先溶于较浓的 中,然后再用蒸馏水稀释到所需的浓度。
(2)把FeCl3溶液加热蒸干,灼烧,最后得到的主要固体产物是 ,原因是(用二个化学方程式来说明): ; 。
18.(6分)
从H+、Cu2+、Na+、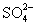 、
、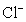 等五种离子中选择适当的离子组成电解质,使之符合下列要求(填化学式):
等五种离子中选择适当的离子组成电解质,使之符合下列要求(填化学式):
(1)以碳棒为电极,一电解时电解质质量减小,水量不变,应选用的电解质是 ;
(2)以碳棒为电极,电解时电解质质量不变,水量减少,应选用的电解质是 ;
(3)以碳棒为阳极,铁棒为阴极,电解时电解质质量和水量都减少,则应选用的电解质是 。
17.(6分)
(1)298K时,由氢气和氧气反应生成l mol水蒸气放热241.8 kJ,写出该反应的热化学方程式 。
(2)已知:①C(s)+O2(g)=CO2(g) △H=△H1;
②2CO(g)+O2(g)=2CO2(g) △H=△H2;
③TiO2(s)+2C12(g)=TiCl4(s)+O2(g) △H=△H3;
则TiO2(s)+2C12(g)+2C(s)=TiCl4(s)+2CO(g)的△H 。
(3)在一密闭容器中充人一定量的N2和H2,经测定反应开始后的2 s内氢气的平均速率:
v(H2)=0.45mol/(L·s),则2 s末NH3的浓度为 。
16.在一密闭容器中,可逆反应aA(g)+bB(g) cC(g)达到平衡后,保持温度不变,将容器容积缩小为原来的l/2,当重新达到平衡时,C的浓度是原来的1.5倍。下列说法正确的是
cC(g)达到平衡后,保持温度不变,将容器容积缩小为原来的l/2,当重新达到平衡时,C的浓度是原来的1.5倍。下列说法正确的是
A.平衡向正反应方向移动 B.C的质量分数增加
C.A的转化率降低 D.a+b=c
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com