
1.有A、B、C、D、E、F、G7瓶不同物质的溶液,它们各是Na2CO3、Na2SO4、KCl、AgNO3、MgCl3、Ca(NO3)2和Ba (OH )2溶液中的一种。为了鉴别,各取少量溶液进行两两混合,实验结果如表所示。表中“↓”表示生成沉淀或微溶化合物,“-”表示观察不到明显变化。试回答下面问题。 ⑴A的化学式是 ,G的化学式是 。判断理由是 。 ⑵写出其余几种物质的化学式。B: ,C: ,D: ,E: ,F: 。
答案:⑴KCl,AgNO3。混合时只生成一种沉淀的是KCl,生成的是AgCl,所以A是KCl,G是AgNO3。 ⑵B:Na2SO4 C:MgCl2 D:Na2CO3 E:Ca(NO3)2 F:Ba(OH)2
点评:该题已给出图表,可以直接抓特殊现象:A和G混合只产生一种沉淀,所以所以A是KCl,G是AgNO3。图象法在解决多种物质鉴别时,可以使问题简单化,抓特殊现象结合其它现象即可解决问题。
8. 如图是一套实验室制取气体的装置。某课外活动小组利用这套装置快速制取Cl2、HCl、和O2。供选用有试剂有:A浓H2SO4 B浓盐酸 C食盐碱地D二氧化锰 E KMnO4 F H2O2
如图是一套实验室制取气体的装置。某课外活动小组利用这套装置快速制取Cl2、HCl、和O2。供选用有试剂有:A浓H2SO4 B浓盐酸 C食盐碱地D二氧化锰 E KMnO4 F H2O2
(1)若要快速制备Cl2应选用--。
(2)若要快速制备HCl应选用--。
(3)若要快速制备O2应选用--。
答案:(1)B、E(2)A、B(3)D、F
热点2:物质的检验、分离和提纯
[考点阐释]
(1)用物理或化学方法使混合物分开并恢复至原状
(2)掌握萃取、分液、蒸馏、升华、渗析等分离方法
(3)不使用试剂或只使用一种试剂鉴别一组物质
(4)根据实验现象推断物质
(5)设计鉴别一组物质的方案
[考察角度]
(1)物质的检验
物质的检验有鉴别、鉴定和推断,鉴定是对于某一种物质的定性检验,根据物质的化学特性,分别检出阳离子、阴离子。推断是通过实验事实,推断出被检验物质的组成和名称。鉴别是对分别存放的两种或两种以上的物质进行定性辨认,可以根据几种物质的颜色、气味、溶解性、溶解时的热效应等不同加以区别。包括一种试剂鉴别多种物质(常用的鉴别试剂有FeCl3溶液、Ba(OH)2溶液、NaOH溶液、Na2CO3溶液、稀H2SO4、Cu(OH)2悬浊液等)和不用其他试剂来鉴别一组物质(一是利用某些物质的物理性质如颜色、气味、溶解性等,首先将其鉴别出来,然后再用该试剂去鉴别其他物质,其二采用一种试剂与其他物质相互反应的现象不同,进行综合分析鉴别)。
(2)物质的分离和提纯
基本原则:不增(不引入新的杂质)、不减(不减少被提纯物)、易分离(被提纯物与杂质)、易复原(被提纯物)。注意: 杂试剂需过量、过量试剂要除尽、除多种杂质要注意加入试剂的顺序、选择最佳队杂途径。
物质的分离与提纯的基本操作归纳如下表:
|
操作名称 |
适用范围 |
实例 |
操作要点 |
|
过滤(溶液洗涤) |
溶与不溶物的分离 |
粗盐提纯 |
一贴二低三靠;加水洗涤溶液除去吸附的离子 |
|
结晶(重结晶) |
固体液体分离 溶解性不同的固体固体可溶物分离 |
食盐溶液的蒸发结晶 KNO3和NaCl混合物的分离 |
加热时不断用玻璃棒搅拌防止溅出,有较多固体析出时撤灯用余热将溶液蒸赶不干 |
|
蒸馏、分馏 |
沸点不同的液体混合物分离 |
石油中各馏分的分离 乙醇、乙酸、乙酸乙酯混合物中分离出乙酸乙酯 |
蒸馏烧瓶要垫石棉网,内部加碎瓷片,温度计水银球放在支管口略下的位置 冷却水和蒸气逆向 |
|
萃取、分液 |
两种互溶液体的分离、两种不互溶液体分离 |
用CCl4 从碘水中分离出碘 |
分液漏斗装液不超过容积的3/4;两手握漏斗、倒转、用力振荡、反复,静置分层,分液 |
|
洗气 |
气气分离(杂质气体与试剂反应) |
饱和食盐水除去Cl2中HCl;溴水除去CH4中的C2H2 |
混合气通过洗气瓶,长进短出 |
|
渗析 |
胶体与溶液中溶质的分离 |
除去淀粉胶体中NaCl |
混合物装入半透膜袋中浸入蒸馏水中适当长时间 |
|
加热 |
杂质发生反应 |
除Na2CO3中NaHCO3;除去MnO2中C |
玻璃棒搅拌使受热均匀 |
|
升华 |
分离易升华的物质 |
碘、萘等的提纯 |
|
|
盐析 |
胶体从混合物中分离 |
硬脂酸钠溶液中加入食盐细粒;蛋清中加入饱和(NH4)2SO4 |
|
|
离子交换 |
溶液中离子从液体中分离 |
软化 |
磺化煤软化硬水 |
(3)常见物质分离提纯归纳
|
混合物,括号内为杂质 |
所用试剂 |
分离方法 |
|
|
NaOH(Na2CO3) |
Ca(OH)2 |
溶解、加试剂、过滤 |
|
|
NaHCO3(Na2CO3) |
CO2 |
溶解、通入足量试剂、蒸发 |
|
|
Na2CO3(NaHCO3) |
|
加热 |
|
|
NaCl(Na2CO3、NaHCO3) |
HCl |
加入足量试剂,蒸发 |
|
|
CO2(HCl、SO2) |
饱和Na2CO3溶液 |
洗气 |
|
|
CO(CO2) |
NaOH |
洗气 |
|
|
CO2(CO) |
CuO |
加热 |
|
|
O2(CO2) |
Na2O2 |
足量试剂充分反应 |
|
|
NaCl(NH4Cl) |
|
加热 |
|
|
KI(I2) |
CCl4 |
加热升华或加试剂萃取 |
|
|
Cl2(HCl) |
饱和NaCl溶液 |
洗气 |
|
|
KNO3(NaCl) |
H2O |
重结晶过滤 |
|
|
Fe2+(Fe3+) |
Fe |
过滤 |
|
|
Fe3+(Fe2+) |
H2O2 |
加入足量试剂 |
|
|
SiO2(CaCO3、CaO) |
HCl |
过滤 |
|
|
烷(烯炔) |
溴水 |
洗气 |
|
|
气态烷、烯、炔(H2S、CO2、SO2) |
NaOH溶液 |
洗气 |
|
|
苯(甲苯) |
KMnO4 酸性溶液 |
分液 |
|
|
苯(苯磺酸) |
NaOH溶液 |
分液 |
|
|
溴苯(溴) |
NaOH溶液 |
分液 |
|
|
甲苯(乙醛) |
水 |
分液 |
|
|
甲苯(苯酚) |
NaOH溶液 |
分液 |
|
|
苯酚(苯) |
NaOH溶液、CO2 |
加NaOH溶液分液,取水层通入中量CO2,分液 |
|
|
溴乙烷(乙醇) |
氷 |
分液 |
|
|
乙醇(水) |
CaO |
蒸馏 |
|
|
乙醇(NaCl) |
|
蒸馏 |
|
|
乙酸(甲酸) |
醋酸钠晶体 |
蒸馏 |
|
|
乙酸乙酯(乙酸、乙醇) |
饱和Na2CO3 |
分液 |
|
|
硬脂酸钠溶液(NaCl) |
半透膜 |
渗析 |
|
|
硬脂酸钠溶液(甘油) |
NaCl粉未 |
盐析、过滤 |
|
|
蛋白质(饱和硫酸铵溶液) |
半透膜 |
渗析 |
|
|
硝基苯(硝酸) |
NaOH溶液 |
分液 |
|
|
淀粉溶液(NaCl) |
半透膜 |
渗析 |
|
|
甲烷(H2S) |
NaOH溶液或CuSO4溶液 |
洗气 |
|
(4) 物质鉴别的常见类型、思路和规律:
①不用任何试剂鉴别多种物质。它要求不用任何试剂(可用水、加热等)将一组物质鉴别。须掌握待鉴物的特性及相互鉴别之反应。
(A)特征现象法:先依据外观特征鉴别出其中一种或几种。再借用它们去鉴别其它物质,思路为:观察 借用
借用 再借用。
再借用。
例:有五瓶溶液它们分别是KCl、Ba(NO3)2 Na2CO3 Na2SO4 和FeCl3溶液,不用其它试剂或试纸,确定那瓶装的是哪种溶液。
思路:先观察溶液显棕黄色的是FeCl3,再以FeCl3鉴别出Na2CO3,再用Na2CO3鉴别出Ba(NO3)2,再用Ba(NO3)2鉴别出Na2SO4和KCl。
(B)焰色反应或加热法:如果几种物质无明显外观特征,可考虑利用加热分解或焰色反应来区别。
例:有四瓶失去标签的药品NaCl、K2SO4、NH4HCO3、NaHCO3,不用其它任何试剂如何将它们区别出来。
思路:先加热鉴别出NH4HCO3、NaHCO3,再用焰色反应鉴别NaCl、K2SO4。
(C)相互混合反应法:若待检物质较多且无明显特征,可以将这组待鉴物质依次编号,然后把它们两两混合,将产生现象列表进行推断一一对号。
例:不用任何试剂鉴别氯化钡、硝酸银、碳酸钠、盐酸四种溶液
思路:将待鉴别的物质分别编号,分别以一种物质作为试剂加入到其它物质中去,将产生的现象列表分析。根据每种物质所产生的不同现象,可确定物质的名称。先将四种溶液分别编为A、B、C、D进行互混实验,将现象列表如下:
|
|
A |
B |
C |
D |
|
A |
-- |
↓ |
-- |
-- |
|
B |
↓ |
-- |
↓ |
↓ |
|
C |
↓ |
↓ |
-- |
↑ |
|
D |
-- |
↓ |
↑ |
-- |
然后进行分析:在四种物质中,能跟另外三种物质反应产生沉淀的只有硝酸银,因此B是硝酸银;能跟其中两种物质反应产生沉淀而跟另一种物质反应产生气体的只有碳酸钠,因此C是碳酸钠;而能跟碳酸钠反应产生气体的物质D必是盐酸;那么A必然是氯化钡。结论为:A是氯化钡,B是硝酸银,C是碳酸钠,D是盐酸。
(D)互滴法:若待鉴物为两种时,且因试剂的加入顺序(量)不同而现象不同,可用相互滴加,根据现象不同加以鉴别。如NaOH溶液和AlCl3溶液, 稀盐酸和Na2CO3溶液。
②限用一种试剂鉴别多种物质:所选试剂与被鉴别物质分别作用时,现象必须分别不同才行。
(A)可先分析被鉴别物质的水溶性、密度、溶液酸碱性、溶解时热效应不同,确定能否选用水或指示剂(石蕊)进行鉴别。如用水可鉴别:苯、乙酸、四氯化碳三种液体;NaOH、NaCl、NH4NO3三种固体。
(B)在鉴别多种酸、碱、盐的溶液时,常可根据“相反原理”选用试剂进行鉴别。若被鉴别的溶液多数呈酸性时,可选用碱或水解呈碱性的盐的溶液鉴别;如:鉴别Mg2+溶液和Al3+溶液,用强碱溶液即可。又如鉴别CaCl2 、H2SO4 Al2(SO4)3 、Na2SO4四种溶液,选用Na2CO3溶液就能将它们一一鉴别出来。
若被鉴别的溶液多数呈碱性时,可选用酸或水解呈酸性的盐的溶液鉴别;如鉴别Na2S、Na2CO3、Na2SO3 、NaCl、NaAlO2溶液,加入盐酸或稀硫酸即可。
若被鉴别的物质为金属单质和金属氧化物时,可选择强酸为试剂进行鉴别;如用一种试剂鉴别铁、炭、氧化亚铁、氧化铜、二氧化锰五种黑色固体物质,可用浓盐酸。
(C)当被鉴物中含有醛基、羟基、羧基时,可考虑使用新制的Cu(OH)2来鉴别。
(D)常常选用溴水、新制氢氧化铜、氯化铁溶液、KMnO4溶液等作试剂来鉴别多种有机物。
③任选试剂鉴别多种物质。此类题目不限所加试剂的种类,可有多种解法,题目考查的形式往往是从众多的鉴别方案中判断最佳方案。其要求是操作步骤简单,试剂选用最少,现象最明显。答题要领如下:
(A)选取的试剂和待鉴的各物质反应现象要专一,并且一目了然。
(B)不许原瓶操作,若原瓶操作,试剂将全部被污染,损耗太大。因此操作中要“各取少许”。
(C)不能指名道姓。因为在加入某试剂前,该物质是未知的,一般简答的顺序是:取样 溶解(固体)
溶解(固体) 加入某试剂
加入某试剂 描述现象
描述现象 得出结论。
得出结论。
[方法指导]
掌握常见物质的检验、分离和提纯的方法和步骤
[考点突破 ]
(1)重点:常见物质的分离和提纯方法
例:与在以下三组混合物:碘与氯化钠固体、石英和氯化铵固体、乙酸乙酯和醋酸钠溶液,其分离方法以依次为( )
A.加不溶解过滤、加热、分液 B.加热、加水溶解过滤、分液
C.分液、加热、加水溶解过滤 D.加热、分液、加水溶解过滤
答案:B
归纳:选择分离和提纯操作一般有以下规则:固体与固体混合物,若杂质易分解或易升华时用加热法;若一种易溶另一种难溶用溶解过滤法;若两者均易溶可以据溶解度不同用重结晶法。液体与液体混合物,若沸点差别较大时用分馏法;若不互溶时用分液法;若在不同溶剂中的溶解度相差很大,用萃取法;对某些溶质直径有区别的物质可用渗析法。气体与气体混合物一般用洗气法。不具备上述条件的混合物,先用化学法处理,再选用适当的试剂或方法进行分离。
(2)难点 :物质的检验
例:有两瓶失去标签的白色固体:一瓶是硫酸钠,一瓶是氯化铵。请你设计四种实验方案加以鉴别,简要写出操作过程、实验现象和结论。
答案:
|
方法 |
操作与现象 |
结论 |
|
加热法 |
取两种样品,分别置于两支试管中,用酒精灯加热,一支试管中固体无明显变化,另一支中固体最后类似于升华,在试管上部析出固体 |
无明显变化的是硫酸钠,另一是氯化铵 |
|
加碱法 |
分别取两种样品,各加入一定量烧碱在研钵中研磨,一个有氨臭味 |
有氨臭味的是氯化铵,另一个为硫酸钠 |
|
加盐法 |
分别取两种样品置于两去试管中,加水溶解,再在两支试管中各加入一定量的氯化钡溶液,一支产生白色沉淀,另一支无明显变化 |
有白色沉淀生成的是硫酸钠,另一支是氯化铵 |
|
试纸法 |
分别取两种样品置于两去试管中,加水溶解,用pH试纸测两溶液pH值,一为中性,一为酸性 |
中性的为硫酸钠,酸性的为氯化铵 |
归纳:物质的检验通常有鉴定、鉴别和推断。
(3)疑点:物质的推断
例:有一无色溶液,可能含有K+、Al3+、Mg2+、NH4+、Cl-、SO42-、HCO3-、MnO4-中的一种或几种。为确定其成份,做如下实验:取部分溶液,加入适量Na2O2固体产生无色无味的气体和白色沉淀,再加入足量的NaOH溶液后白色沉淀部分溶解;另取部分溶液,加入硝酸酸化的硝酸钡溶液,有白色沉淀生成。下列推断正确的是( )
A.肯定有K+、HCO3-、MnO4- B.肯定有Al3+、Mg2+、HCO3-
C.肯定有Al3+、Mg2+、SO42- D.肯定有Al3+、Mg2+、NH4+、Cl-
答案:C
归纳:推断要依据物质的特征性质和特征反应
[例题剖析]
7.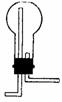 右图的烧瓶时充满了空气。将此装置就这样倒置固定,对CH3CH3、H2、SO2、NO、C2H2、NO2、CH4等气体,可用此装置收集的是(写物质的化学式)
右图的烧瓶时充满了空气。将此装置就这样倒置固定,对CH3CH3、H2、SO2、NO、C2H2、NO2、CH4等气体,可用此装置收集的是(写物质的化学式)
答案:H2、SO2、C2H2、NO2、CH4
6.双球洗气管是一种多用途仪器,常用于去除杂质、气体干燥、气体吸收(能防止倒吸)等实验操作。右图是用水吸收某种气体时的情形,根据下面附表判断由左方进入的被吸收气体是( )
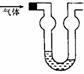 A.Cl2 B.HCl C.H2S D.CO2
A.Cl2 B.HCl C.H2S D.CO2
附:四种气体的溶解度表(室温下)
|
气体 |
Cl2 |
HCl |
H2S |
CO2 |
|
1体积水能吸收气体的体积数 |
2 |
500 |
2.6 |
1 |
答案:B
5.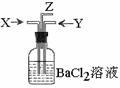 碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法正确的是( )
碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法正确的是( )
A.气瓶中产生的沉淀是碳酸钡
B.Z导管出来的气体中无二氧化碳
C.气瓶中产生的沉淀是硫酸钡
D.Z导管口有红棕色气体出现
答案:CD
4.以下各种尾气吸收装置中,适合于吸收易溶性气体,而且能防止倒吸的是( )

答案:BD
3.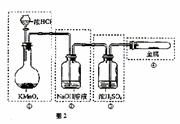 已知KMnO4与浓HCl在常温下反应能产生Cl2.若用图2所示的实验装置来制备纯净、干燥的氯气,并试验它与金属的反应.每个虚线框表示一个单元装置,其中错误的是( )
已知KMnO4与浓HCl在常温下反应能产生Cl2.若用图2所示的实验装置来制备纯净、干燥的氯气,并试验它与金属的反应.每个虚线框表示一个单元装置,其中错误的是( )
A.只有①和②处 B.只有②处
C.只有②和③处 D.只有②、③、④处
答案:D
2.下列三个问题均与下图实验装置有关,请选择A--B等序号填入括号内。
(1)制取某无色氧化物气体时,锥形瓶X内的药品应是( )
A.铜和稀硝酸 B.铜和浓硝酸
 C.碳酸钙和稀硫酸 D.亚硫酸钠和浓盐酸。
C.碳酸钙和稀硫酸 D.亚硫酸钠和浓盐酸。
(2)洗气瓶Y中所装的液体应是(不允许非水杂质混在气体中)( )
A.浓硫酸 B.氢氧化钠溶液
C.亚硫酸氢钠溶液 D.碳酸氢钠溶液
(3)检验集气瓶Z是否集满气体,置于瓶口的滤纸应蘸上的溶液是( )
A .BaCl2溶液 B.酸性KmnO4溶液
C.碘化钾淀粉试纸 D.澄清石灰水。
答案:B
1. 图3装置可以用来发生、洗涤、干燥、收集(不考虑尾气处理)气体。该装置可用于
图3装置可以用来发生、洗涤、干燥、收集(不考虑尾气处理)气体。该装置可用于
A锌和盐酸生成氢气。
B二氧化锰和浓盐酸生成氯气。
C碳酸钙和盐酸生成二氧化碳。
D氯化钠和浓硫酸生成氯化氢
答案:A
4.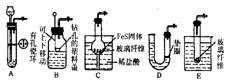 现有下列用品:仪器:单孔橡皮塞、双孔橡皮塞、球形干燥管、破底试管、U形管、塑料垫盖、烧杯、、铜丝、带活塞的导管等。药品:FeS固体、浓H2SO4、蒸馏水、浓盐酸、Na2S固体。试运用创造性思维,设计出尽可能多的简易的能随开随用、随关随停的H2S气体发生器。(画出装置图)
现有下列用品:仪器:单孔橡皮塞、双孔橡皮塞、球形干燥管、破底试管、U形管、塑料垫盖、烧杯、、铜丝、带活塞的导管等。药品:FeS固体、浓H2SO4、蒸馏水、浓盐酸、Na2S固体。试运用创造性思维,设计出尽可能多的简易的能随开随用、随关随停的H2S气体发生器。(画出装置图)
答案:
点拨:本题为开放性试题,以考查学生的创新能力,答案中的创新灵感请同学们细心口味和深刻体会。
[强化训练]
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com