
2.氢氧化铝
①)物理性质
Al(OH)3是 固体, 溶于水,若溶液中生成,Al(OH)3为 物,且有吸附水中悬浮物和色素的能力
②化学性质(典型的 氢氧化物)

 H++AlO2-+H2O Al(OH)3 Al3++3OH-
H++AlO2-+H2O Al(OH)3 Al3++3OH-
与强酸反应,其离子方程式为
与强碱溶液反应,其离子方程式为
热不稳定性:
③制备方法:
实验室中制取少量的氢氧化铝常用可溶性的铝盐与 反应,反应的离子方程 式为 。
思考:能否用可溶性的铝盐与强碱反应制取?
1.氧化铝
①)物理性质
Al2O3是 固体,其天然晶体叫 ,硬度大,熔点高(为2072℃),是很好的耐火材料
②化学性质(典型的 氧化物)
与强酸反应,其离子方程式为
与强碱溶液反应,其离子方程式为
思考:铝与强碱溶液反应的实质是什么?标出其电子转移方向和数目。
③用途
作 材料,如制 、 等;作冶炼铝的原料;红、蓝宝石。
2.化学性质:
① 与氧气发生反应:
常温下,铝在空气中发生 现象,因此常温下铝制品具有抗腐蚀的性能,但若遇到含有 的溶液,会受到破坏,不宜长期放置。
点燃Al在纯氧中剧烈燃烧:
② 在常温下,铝遇到 、 发生钝化。
③ 与非金属发生反应:
与Cl2 反应: 与S 反应:
④ 与非氧化性酸发生反应:
与稀硫酸反应,离子方程式为
⑤ 铝是一种典型的两性金属,不仅能与酸反应,还能与强碱溶液反应,如与氢氧化钠溶液反应的离子方程式为 。
⑥ 与盐溶液发生反应
与不活泼金属的盐溶液(如硝酸汞):
与强氧化性盐溶液(如氯化铁):
⑦与金属氧化物反应(又叫 )
与氧化铁:
1.物理性质:
铝是 色、带有金属光泽的固体,硬度 、较 ,具有良好的导电性、导热性和延展性。
2.从铝土矿中提取铝的工艺流程为:
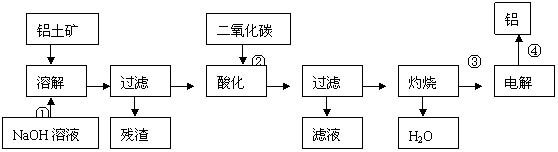
写出反应的化学方程式:
①
②
③
④
1.铝元素位于周期表 、 族,是较活泼的金属元素,在自然界中以 态存在,在地壳中的含量占金属中的第 位,铝元素在地壳中主要存在的物质是 。
2.sina-sinb=-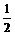 ,cosa-cosb=
,cosa-cosb=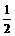 ,aÎ(0,
,aÎ(0, 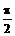 ),bÎ(0,
),bÎ(0, 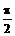 ),求cos(a-b)的值
),求cos(a-b)的值
解: ∵sina-sinb=-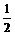 ,cosa-cosb=
,cosa-cosb=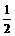 ,aÎ(0,
,aÎ(0, 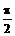 ),bÎ(0,
),bÎ(0, 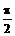 ),
),
∴(sina-sinb)2=(-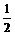 )2,(cosa-cosb)2=(
)2,(cosa-cosb)2=(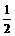 )2
)2
∴2-2 cos(a-b)=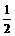 ∴cos(a-b)=
∴cos(a-b)=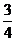
1.已知cos(a-b)=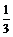 ,求(sina+sinb)2+(cosa+cosb)2的值
,求(sina+sinb)2+(cosa+cosb)2的值
解: (sina+sinb)2+(cosa+cosb)2=2+2 cos(a-b)=2+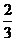 =
=
例1 计算① cos105°
②cos15° ③cos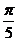 cos
cos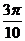 -sin
-sin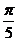 sin
sin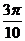
解:①cos105°=cos(60°+45°)=cos60°cos45°-sin60°sin45°
=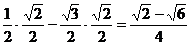
②cos15° =cos(60°-45°)=cos60°cos45°+sin60°sin45°
=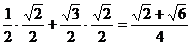
③cos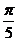 cos
cos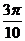 -sin
-sin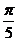 sin
sin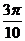 = cos(
= cos(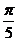 +
+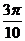 )=cos
)=cos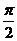 =0
=0
例2已知sina=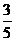 ,cosb=
,cosb=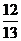 求cos(a-b)的值
求cos(a-b)的值
解:∵sina=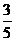 >0,cosb=
>0,cosb=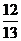 >0
>0
∴a可能在一、二象限,b在一、四象限
若a、b均在第一象限,
则cosa=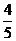 ,sinb=
,sinb=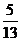 cos(a-b)=
cos(a-b)=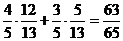
若a在第一象限,b在四象限,
则cosa=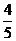 ,sinb=-
,sinb=-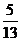 cos(a-b)=
cos(a-b)=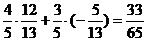
若a在第二象限,b在一象限,
则cosa=-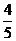 ,sinb=
,sinb=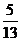 cos(a-b)=
cos(a-b)=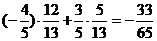
若a在第二象限,b在四象限,
则cosa=-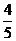 ,sinb=-
,sinb=-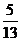 cos(a-b)=
cos(a-b)=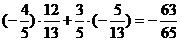
例3已知cos(2α-β)=-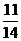 ,sin (α-2β)=
,sin (α-2β)=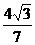 ,且
,且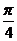 <α<
<α<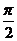 ,0<β<
,0<β<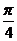 ,
,
求cos(α+β)的值
分析:已知条件中的角与所求角虽然不同,但它们之间有内在联系,
即(2α-β)-(α-2β)=α+β 由α、β角的取值范围,分别求出2α-β、α-2β角的正弦和余弦值,再利用公式即可求解
由α、β角的取值范围,分别求出2α-β、α-2β角的正弦和余弦值,再利用公式即可求解
解:∵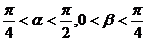 ,
,
∴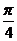 <2α-β<π,-
<2α-β<π,- 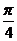 <α-2β<
<α-2β<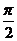 ,
,
由cos(2α-β)=-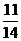 得,sin (2α-β)=
得,sin (2α-β)=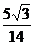 ;
;
由sin (α-2β)=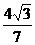 得,cos(α-2β)=
得,cos(α-2β)=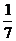

∴cos(α+β)=cos[(2α-β)-(α-2β)]=cos(2α-β)cos(α-2β)+sin (2α-β)sin (α-2β)=- 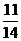 ×
×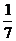 +
+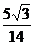 ×
×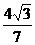 =
=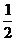

评注:在三角变换中,首先应考虑角的变换 如何变换角?一定要根据题目的条件与结论来变,简单地说就是“据果变形”,创造出使用三角公式的条件,以达到求值、化简和证明的目的
如何变换角?一定要根据题目的条件与结论来变,简单地说就是“据果变形”,创造出使用三角公式的条件,以达到求值、化简和证明的目的 常用的变换角的方法有:α=(α+β)-β,α+2β=(α+β)+α,α=
常用的变换角的方法有:α=(α+β)-β,α+2β=(α+β)+α,α=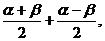
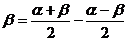 ,…
,…
8.探究 cos(a-b)的公式
以-b代b得: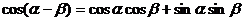
公式记号
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com