
8、学生刘鹏对长跑缺乏信心,老师用一句话鼓励他。下列不贴切的一句话是( )(2分)
A、只有不快的斧,没有劈不开的柴。 B、只要功夫深,铁铁杵磨居针。
C、万般皆下品,惟有读书高。 D、不怕慢,只怕站。
7.古诗文默写(10分,每空1分)
(1)任选4句作答(4分)
① ,一览众山小。(杜甫《望岳》)
②浮云游子意, 。(李白《送友人》)
③ ,不尽长江滚滚来。(《登高》)
④山重水复疑无路, 。(陆游《游山西村》)
⑤不畏浮云遮望眼,_ .(王安石《登飞来峰》)
(2)根据提示写出相关诗句。(6分)
⑥ 面对离别,岑参在《白雪歌送武判官归京》中,为归京的友人吟诵:“山回路转不见君, ”,表达依依不舍之情;王勃在《送杜少府之任蜀州》中,与入川的朋友作别:“ ,天涯若比邻”,尽显洒脱旷达之意。
⑦范仲淹几经沉浮,数遭贬谪,但始终以天下为己任,忧国忧民,为民请命,实践了他“ , ”的伟大抱负,(《岳阳楼记》)
⑧今年四月,浙江一位老人捐献出的眼角膜让两位盲人重见光明。老人的这种精神正是龚自珍《己亥杂诗》中“ ,
”的写照。
6.请把下面的一项关于乘飞机的规定压缩为一句话。要求符合原意,不超过55字(含标点)。(3分)
乘坐国际民航班机要接受安全技术检查,乘坐国内民航班机也要接受安全技术检查。无论是中国人还是外国人,都要接受安全技术检查。他们携带的行李物品,也要接受安全技术检查。检查时间在登机之前。经过有关部门准许的,可以免予检查。
5.下列文学常识中,有误的一项是( ) (3分)
A.《敬业与乐业》一文,梁启超阐述了人生与事业的关系。
B.雨果的演讲,是对人类先贤伏尔泰关于思想与人格力量的礼赞。
C.苏联教育家苏霍姆林斯基通过书信形式,阐述了自己的主张,反对女儿早恋。
D.通过书信形式,傅雷劝慰、激励儿子保持谦卑,不惧孤独,勇于攀登艺术高峰。
4、下列句子没有语病的一句是 ( ) (3分)
A.笔记本电脑显示了快捷、稳定、方便而成为奥运新闻报道的重要工具。
B.事实证明,经过艰苦生活磨炼的人更善于战胜各种困难和挫折。
C.通过收看专题片,使我们认识到人类要与动物和谐共处。
D.今年学校取得巨大成就的原因是全校师生共同努力的结果。
3、下列句子中加点的成语使用正确的一项是( )(3分)
A.这行云流水般的歌声使所有在场的听众获得了极大的艺术享受。
B.一方困难,八方支援,被洪水冲得囊空如洗的灾区又重建了家园。
C.这么好的天气去郊游,同学们可以在大自然中尽情地享受天伦之乐。
D.凡是优秀的演员,总能把剧中人物的内心世界表演得惟妙惟肖。
2、词语书写全部正确的一项是 ( )(3分)
A.不言而喻 悠扬悦目 亭亭玉立 心旷神怡
B.名不虚传 举不胜举 克不容缓 大型屏幕
C.蔓延繁殖 气候干躁 馨竹难书 倚丽风光
D.恳荒伐木 青梅竹马 矫娜多姿 琳琅满目
1.下面语段中加点字注音无误的一项是( )(3分)
世上本无沙漠。我反复这样对自己说。我知道,我的旅途依然遥迢,苍凉的风景依然会冰痛我热切的眼眸。如果黄昏再度借给我天光,我或许还会在手机上傻傻地拼写“世上本无……”但是,我仅是写写而已,我仅是想用这几行率性的汉字,暖我的屏。
A.遥迢(tiāo)B.眼眸(mú) C.率性(shuài) D.暖我的屏(pín)
3.铝盐和偏铝酸盐
(1) 铝盐性质:
①铝盐溶液发生水解反应,使溶液呈酸性。
思考:明矾的化学式为 ,在日常生活中明矾用于 。②铝盐与碱溶液反应
与强碱溶液发生反应:适量强碱:
过量强碱:
与弱碱(氨水)发生反应:
思考:写出Al2(SO4)3溶液与Na2S、NaHCO3、Na2CO3溶液反应的离子方程式。
(2) 偏铝酸盐性质:
①偏铝酸盐溶液发生水解反应,溶液呈碱性。
②偏铝酸盐与酸反应
与强酸发生反应:适量强酸:
过量强酸:
与弱酸(H2CO3)发生反应:即通入CO2气
适量CO2:
过量CO2:
③铝盐与偏铝酸盐溶液反应:
思考:分析以下几种情况中Al3+与强碱反应,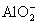 与强酸反应的现象及图像
与强酸反应的现象及图像
①把强碱溶液逐滴加入到铝盐(Al3+)中至过量:
②把 铝盐(Al3+)逐滴加入到强碱中至过量:
③在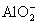 溶液中逐滴加入强酸至过量:
溶液中逐滴加入强酸至过量:
④在强酸溶液中逐滴加入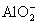 至过量:
至过量:
试题枚举
[例1]1989年世界卫生组织把铝确定为食品污染源之一,加以控制使用,铝在下列应用时应加以控制的是 ( )
①制铝合金 ②制电线 ③制炊具 ④明矾净水 ⑤明矾和苏打制食品膨松剂 ⑥用氢氧化铝凝胶制胃舒平药品 ⑦银色漆颜料 ⑧制易拉罐 ⑨包装糖果和小食品
A.全部 B.③⑤⑧⑨ C.⑥⑧⑨ D.③④⑤⑥⑧⑨
解析: “D”中所涉及的铝与进入食品、饭、水等中,并被人体吸收,所以要加以控制。
答案: D
[例2]在下列各物质中,加入过量盐酸后,最终不产生沉淀或浑浊的是
A.偏铝酸钠溶液 B.苯酚钠溶液 C.硅酸钠溶液 D.硫代硫酸钠溶液
解析:各选项中产物依次为Al(OH)3、C6H5OH、H2SiO3、S。但Al(OH)3是两性氢氧化物,能溶于过量的盐酸中。
答案:A
[变式]将表面已完全钝化的铝条,插入下列溶液中,不会发生反应的是
A.稀硝酸 B.稀盐酸 C.硝酸铜 D.氢氧化钠
[例3]将等物质的量的镁和铝相混合,取等质量该混合物四份,分别加到足量的下列溶液中,充分反应后,放出氢气最多的是
A.3mol/LHCl B.4mol/LHNO3 C.8mol/LNaOH D.18mol/LH2SO4
解析:在镁、铝混合物中加入HNO3和浓H2SO4(两物质均具有强氧化性)都不能产生H2,加入NaOH溶液只有Al与NaOH溶液反应生成H2而与Mg不反应。而加入HCl,Mg和Al都与盐酸反应生成H2,所以H2量最多。
答案:A
[例4]甲、乙两烧杯中各盛有100mL3mol/L的盐酸和氢氧化钠溶液,向两烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体体积比为甲:乙=1:2,则加入铝粉的质量为
A.5.4g B.3.6g C.2.7g D.1.6g
解析:根据铝与盐酸和氢氧化钠溶液反应的方程式判断,若在含等物质的量的HCl和NaOH溶液中分别加入足量的铝粉,产生的H2之比为1:3。而题中为1:2,说明铝粉的量相对盐酸是过量的,而对NaOH是不足的。与前者反应的铝粉是2.7g,则与后者反应的铝粉应为5.4g。
答案:A
[变式] 氢化钠是一种离子晶体,它与水反应时生成氢氧化钠和氢气,现有氢化钠和铝粉m g,与足量的水反应后铝无剩余,若收集到氢气n g,则混合物中铝粉的质量为:( )
A.36n-3m B.m-24n/5 C.12n-m D.24m-5n
[例5]若在加入铝粉能放出氢气的溶液中,分别加入下列各组离子,可能共存的是
A.NH4+ NO3- CO32- Na+ B.Na+ Ba2+ Mg2+ HCO3-
C.NO3- Ca2+ K+ Cl- D.NO3- K+ AlO2- OH-
解析:铝粉加入酸溶液或强碱溶液中均可放出H2,A中NH4+与OH-不能大量共存,CO32-不能与H+大量共存;B中HCO3-既能与H+反应又能与OH-反应;C、D在强碱条件下可以共存。
答案:C、D
[例6]已知Ba(AlO2)2可溶于水。右图表示的是向A12(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加人Ba(OH)2的物质的量x的关系。下列有关叙述正确的是
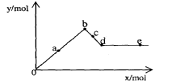 A.a-b时沉淀的物质的量:A1(OH)3比BaSO4多
A.a-b时沉淀的物质的量:A1(OH)3比BaSO4多
B.c-d时溶液中离子的物质的量:AlO2-比Ba2+多
C.a-d时沉淀的物质的量: BaSO4可能小于A1(OH)3
D.d-e时溶液中离子的物质的量:Ba2+可能等于OH-
解析:设A12(SO4)3溶液中含1mol A12(SO4)3,既含2molAl3+和3molSO42-。
[o-a-b] 离子反应:2molAl3+ + 3molSO42- + 3Ba2+ + 6OH- = 3BaSO4↓+2Al(OH)3↓
沉淀为BaSO4 和Al(OH)3 其物质的量之比为 3:2 。b点达最大值,为5mol,此时加入的Ba(OH)2为3mol
(b-c-d )加入的Ba(OH)2,仅OH- 参与离子反应: 2Al(OH)3 + 2OH- = 2AlO2- + 4H2O 每消耗2mol OH-则生成2AlO2-,是留在溶液中Ba2+的两倍。沉淀混合物中Al(OH)3随加入的Ba(OH)2不断溶解.当加入的Ba(OH)2为4mol时, Al(OH)3沉淀恰好溶解完。d点沉淀达最小值组成全为BaSO4, 既y=3mol ,x=4mol. 此时,若不考虑AlO2-的水解,反应后溶液中溶质仅为1mol Ba(AlO2)2, 既 1mol Ba2+ 和 2molAlO2-
[d-e---] 再加入的Ba(OH)2 不发生离子反应,沉淀量不变,只是增加了溶液中的Ba2+和OH- 离子.显然,当再加入1mol Ba(OH)2 ,既x=5mol ,此时溶液中的n(Ba2+)=1mol+1mol=2mol, n(OH-)=2mol , 两种离子的物质的量相等.
答案:B D.
[例7]
 将溶液(或气体)X,逐渐加入(或通入)到一定量的Y溶液中,产生沉淀的量与加入X物质的量的关系如图,符合图中情况的一组物质是
将溶液(或气体)X,逐渐加入(或通入)到一定量的Y溶液中,产生沉淀的量与加入X物质的量的关系如图,符合图中情况的一组物质是
|
|
A |
B |
C |
D |
|
X |
H2S |
HCl |
NH3 |
NH3.H2O |
|
Y |
Na2SO3 |
NaAlO2 |
AlCl3 |
AgNO3 |
解析:由图可知,B中加入试剂1份,沉淀完全,再加入3份,
沉淀全溶解。
NaAlO2+HCl+H2O=Al(OH)3↓+NaCl Al(OH)3+3HCl=AlCl3+3H2O
A中二者反应生成S,继续通入不溶解;C中通入NH3生成沉淀,继续通入也不溶;而D中AgNO3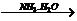 AgOH↓
AgOH↓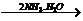 [Ag(NH3)2]++OH-。
[Ag(NH3)2]++OH-。
答案:B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com