
5、(2010·唐山模拟) A、B、C、D四种物质间能够实现下列转化,不符合转化关系的A物质是( )
A.硅 B.硫 C.钠 D.氯气
[解析]选A。硫可以与氧气生成二氧化硫后进一步与氧气反应生成三氧化硫,B项正确;钠在空气中缓慢氧化可得氧化钠,在空气中加热又可得到过氧化钠,C项正确;氯气可以和铁反应生成三氯化铁,三氯化铁可以和铁反应生成氯化亚铁,D项正确。
4、(2010·荆门模拟)当压力达到220atm、温度达到374℃时,水可将CO2等含碳化合物转化为有机物,这就是“水热反应”,生物质在地下高温高压条件下通过水热反应可生成石油、煤等矿物能源。下列说法不正确的是( )
A.二氧化碳与超临界水作用生成汽油的反应,属于放热反应
B.“水热反应”是一种复杂的物理化学变化
C.火力发电厂可以利用废热,将二氧化碳转变为石油
D.通过“水热反应”制取能源有望实现地球上碳资源的和谐循环
[解析]选A。从题意不难看出该反应属于吸热反应,A项错误。
3、(2010·东方模拟)从下列事实所得出的相应结论正确的是( )
|
|
实 验 事 实 |
结 论 |
|
① |
Cl2的水溶液可以导电 |
Cl2是电解质 |
|
② |
将燃烧的镁条放入CO2中能继续燃烧 |
还原性:Mg>C |
|
③ |
NaHCO3溶液与NaAlO2溶液混合产生白色沉淀 |
酸性:HCO3->Al(OH)3 |
|
④ |
常温下白磷可自燃而氮气须在放电时才与氧气反应 |
非金属性:P>N |
|
⑤ |
某无色溶液中加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝 |
该溶液一定有NH4+ |
A.③④⑤ B.②③⑤ C.①②③ D.全部
[解析]选B。电解质必须是化合物①错误;氮气与氧气难以反应是因为氮气含有三键,非金属性:N>P,④错误。
2、(2010·广州模拟)有些科学家提出硅是“21世纪的能源”,这主要是由于作为半导体材料的硅在太阳能发电过程中具有重要的作用。下列有关硅的说法中,不正确的是( )。 A. 高纯度的硅广泛用于制作计算机
B. 硅可由二氧化硅还原制得
C. 低温时,硅与水、空气和酸不反应,但能与氢氟酸反应 D. 自然界中硅的储量丰富,自然界中存在大量的单质硅 [解析]选D。由于硅是亲氧元素,自然界中无单质硅,D项错误。
1、(2010·云浮模拟)联合国气候变化大会2009年12月7日在丹麦首都哥本哈根拉开帷幕,很多人称这次大会为“人类拯救地球的最后机会”。据报道,在火星和金星大气层中发现了一种非常特殊的会导致温室效应的气态化合物,它的结构式为:16O=C=18O。下列说法正确的是 ( )
A.16O与18O为同种核素
B.16O=C=18O与16O=C=16O互为同位素
C.16O=C=18O的化学性质与16O=C=16O完全不同
D.目前提出的“零碳经济”,目标是不再向环境排放CO2,有利于控制温室效应
[解析]选D。16O与18O互为同位素,A项错误;16O=C=18O与16O=C=16O是两种分子不可能互为同位素,B项错误;16O=C=18O与16O=C=16O结构相似,化学性质应该相似,C项错误。
例1  已知正三棱锥
已知正三棱锥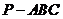 的底面边长为
的底面边长为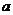 ,过
,过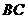 作截面
作截面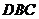 垂直侧棱
垂直侧棱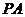 于
于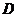 ,且此截面与底面成
,且此截面与底面成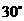 的二面角,求此三棱锥的侧面积.
的二面角,求此三棱锥的侧面积.
解:作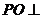 底面
底面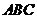 ,垂足为
,垂足为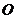 ,则
,则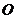 是
是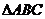 中心,
中心,
连结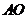 并延长交
并延长交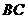 与
与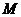 ,连结
,连结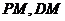 ,
,
则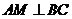 ,
,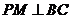 ,∴
,∴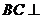 面
面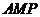 ,
,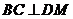 ,
,
∴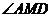 是二面角
是二面角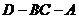 的平面角,
的平面角,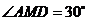
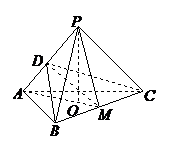 ∵
∵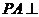 面
面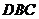 ,
, ,
,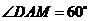 ,
,


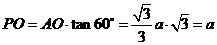 ,
,
在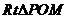 中,
中,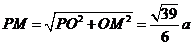 ,
,
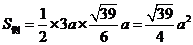 .
.
例2.已知正三棱锥的高为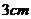 ,一个侧面三角形的面积为
,一个侧面三角形的面积为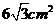 ,求这个正三棱锥的侧面和底面所成的二面角
,求这个正三棱锥的侧面和底面所成的二面角
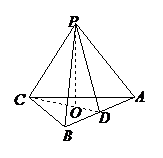 解:设正三棱锥
解:设正三棱锥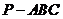 ,高
,高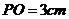 ,
, ,
,
作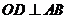 于
于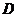 ,连接
,连接 ,
,
由三垂线定理知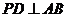 ,
,
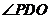 为所求的侧面和底面所成的二面角的平面角,
为所求的侧面和底面所成的二面角的平面角,
设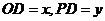 ,则
,则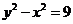 ,又
,又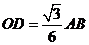 ,
,
∴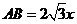 .
.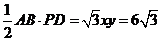 ,∴
,∴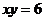 .
.
由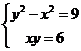 ,得
,得 ,
,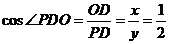 ,∴所求二面角为
,∴所求二面角为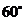 .
.
例3.如图,正四棱锥 中,所有棱长都是
中,所有棱长都是 ,
,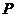 为
为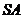 的中点,
的中点,
 (1)求二面角
(1)求二面角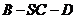 的大小;
的大小;
(2)如果点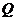 在棱
在棱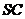 上,那么直线
上,那么直线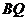 与
与 能否垂直?
能否垂直?
请说明理由
解:(1)取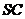 的中点
的中点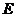 ,连结
,连结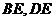 ,
,
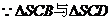 是正三角形,
是正三角形,
∴ 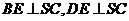 ,
,
∴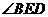 是二面角
是二面角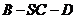 的平面角,
的平面角,
在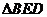 中,
中,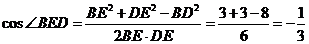 ,
,
∴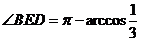 ,
,
故二面角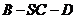 的大小为
的大小为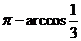 .
.
(2)设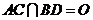 ,以射线
,以射线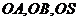 分别为
分别为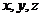 轴建立空间直角坐标系,设
轴建立空间直角坐标系,设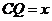 ,
,
则 ,
,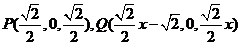 ,
,
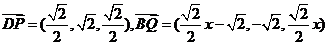 ,
,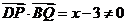
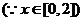 ,∴
,∴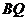 与
与 不可能垂直
不可能垂直
说明:证明线线垂直可以建系证明或用三垂线定理证明
例4.已知三棱锥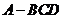 中,
中,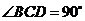 ,
,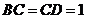 ,
,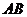 ⊥平面
⊥平面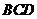 ,
, ,
,
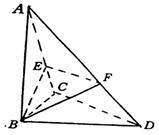
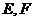 分别是
分别是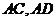 上的动点,且
上的动点,且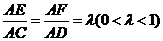 ,
,
(Ⅰ)求证:不论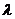 为何值,总有平面
为何值,总有平面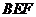 ⊥平面
⊥平面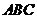 ;
;
(Ⅱ)当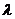 为何值时,平面
为何值时,平面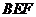 ⊥平面
⊥平面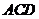 ?
?
证(Ⅰ)∵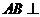 平面
平面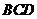 ,∴
,∴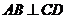 ,
,
∵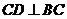 ,且
,且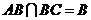 ,∴
,∴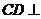 平面
平面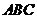 ,
,
又∵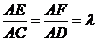 (
(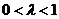 ),
),
∴不论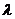 为何值,恒有
为何值,恒有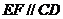 ,∴
,∴ 平面
平面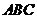 ,
,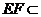 平面
平面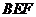 ,
,
∴不论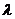 为何值恒有平面
为何值恒有平面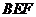 ⊥平面
⊥平面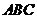 .
.
(Ⅱ)由(Ⅰ)知, ,又要平面
,又要平面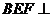 平面
平面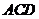 ,
,
∴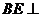 平面
平面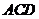 ,∴
,∴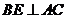 ,
,
∵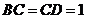 ,
,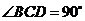 ,
, ,
,
∴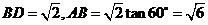 ,
,
∴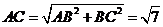 ,由
,由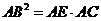 得
得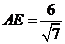 ,
,
∴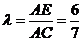 ,
,
故当 时,平面
时,平面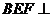 平面
平面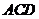 .
.
例5.如图,在棱锥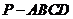 中,侧面
中,侧面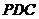 是边长为2的正三角形,且与底面垂直,底面
是边长为2的正三角形,且与底面垂直,底面 是菱形,且
是菱形,且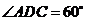 ,
,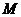 为
为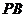 的中点,
的中点,
(Ⅰ)求证: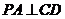 ;(Ⅱ)求二面角
;(Ⅱ)求二面角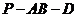 的大小;
的大小;
(Ⅲ)求证:平面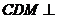 平面
平面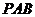 .
.
分析:(Ⅲ)中平面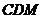 与平面
与平面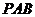 的公共棱不明显,因而可证明其中一个平面内的某一直线垂直于另一个平面.
的公共棱不明显,因而可证明其中一个平面内的某一直线垂直于另一个平面.
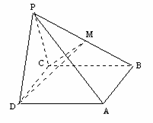 证明:(Ⅰ)取
证明:(Ⅰ)取 中点
中点 ,连结
,连结 ,
,
∵侧面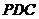 是边长为
是边长为 的正三角形,∴
的正三角形,∴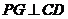 ,
,
∵侧面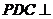 底面
底面 ,∴
,∴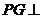 底面
底面 ,
,
在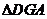 中,
中,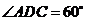 ,
,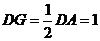 ,
,
∴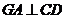 ,由三垂线定理知
,由三垂线定理知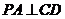 .
.
(Ⅱ)∵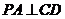 ,
,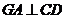 ,
,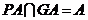 ,∴
,∴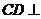 平面
平面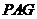 ,
,
∵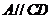 ,∴
,∴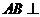 平面
平面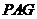 ,∴
,∴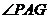 是二面角
是二面角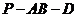 的平面角,
的平面角,
∵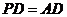 ,∴
,∴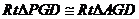 ,
,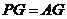 ,
,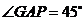 ,
,
∴二面角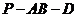 为
为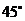 .
.
(Ⅲ)取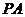 中点
中点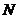 ,连结
,连结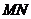 ,则
,则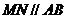 ,又
,又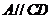 ,∴
,∴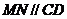 ,
,
又∵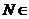 平面
平面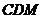 ,
,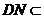 平面
平面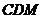 ,
,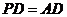 ,∴
,∴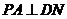 ,
,
又∵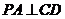 ,且
,且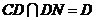 ,
,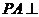 平面
平面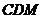 ,
,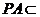 平面
平面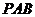 ,
,
∴平面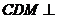 平面
平面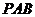 .
.
16.某研究性学习小组在网上收集到如下信息:Fe(NO3)3 溶液可以蚀刻银,制作美丽的银饰。他们对蚀刻银的原因进行了如下探究:
溶液可以蚀刻银,制作美丽的银饰。他们对蚀刻银的原因进行了如下探究:
[实验]制备银镜,并与Fe(NO3)3溶液反应,发现银镜溶解。
(1)下列有关制备银镜过程的说法正确的是 。
a.边振荡盛有2%的AgNO3溶液的试管,边滴入2%的氨水。至最初的沉淀恰好溶解为止。 b.将几滴银氨溶液滴入2 mL乙醛中。 c.制备银镜时,用酒精灯的外焰给试管底部加热。 d.银 氨溶液具有较弱的氧化性。 e.在银氨溶液配制过程中,溶液的pH增大
氨溶液具有较弱的氧化性。 e.在银氨溶液配制过程中,溶液的pH增大
[提出假设]假设1:Fe3+具有氧化性,能氧化Ag。
假设2:Fe(NO3)3溶液显酸性,在此酸性条件下NO3-能氧化Ag。
[设计实验方案,验证假设]
(2)甲同学从上述实验的生成物中检验出Fe2+,验证了假设1成立。请写出Fe3+氧化Ag的离子方程式: 。
(3)乙同学设计实验验证假设2,请帮他完成下表中内容(提示: NO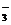 在不同条件下的还原产物较复杂,有时难以观察到气体产生)。
在不同条件下的还原产物较复杂,有时难以观察到气体产生)。
|
实验步骤(不要求写具体操作过程) |
预期现象和结论 |
|
① ② |
若银镜消失,假设2成立。 若银镜不消失,假设2不成立。 |
[思考与交流]
(4)甲同学验证了假设1成立,若乙同学验证了假设2也成立。则丙同学由此得出结论:Fe(NO3)3溶液中的Fe3+和NO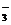 都氧化了Ag。你是否同意丙同学的结论,并简述理由:
。
都氧化了Ag。你是否同意丙同学的结论,并简述理由:
。
15.孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物,实验室以孔雀石为原料制备CuSO4·5H2O及CaCO3,步骤如下:
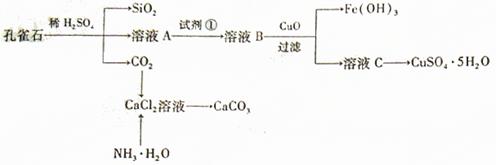
请回答下列问题:
(1)溶液A的金属离子有Cu2+、Fe2+、Fe3+。从下列所给试剂中选择:实验步骤中试剂①为 (填代号),检验溶液A中Fe3+的最试剂为 (填代号)。
a.KMnO4 b.(NH4) 2S c.H2O2 d.KSCN
(2)由溶液C获得CuSO4·5H2O,需要经过加热蒸发, 。过滤等操作。除烧杯、漏斗外,过滤操作还用到另一玻璃仪器,该仪器在此操作中的主要作用是 。
(3)制备CaCO3时,应向CaCl2溶液中选通入(或先加入) (填化学式)。若实验过程中有氨气逸出、应选用下列 装置回收(填代号)。
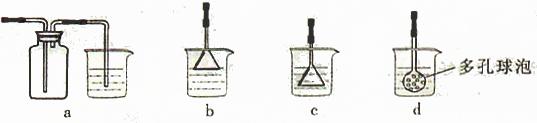
(4)欲测定溶液A中Fe2+的浓度,需要用容量瓶配制某标准溶液,定容时视线应 ,直到 。用KMnO4标准溶液滴定时应选用 滴定管(填“酸式”或“碱式”)。
14.硫酸亚铁(FeSO4·7H2O)是一种重要的食品和饲料添加剂。实验室通过如下实验由废铁屑制备FeSO4·7H2O晶体:
①将5% Na2CO3溶液加入到盛有一定量废铁屑的烧杯中,加热数分钟,用倾析法除去Na2CO3溶液,然后将废铁屑用水洗涤2-3遍;
②向洗涤过的废铁屑中加入过量的稀硫酸,控制温度在50-80℃之间至铁屑耗尽;
③趁热过滤,将滤液转入到密闭容器中,静置、冷却结晶;
④待结晶完毕后,滤出晶体,用少量冰水洗涤2-3次,再用滤纸将晶体吸干;
⑤将制得的FeSO4·7H2O晶体放在一个小广口瓶中,密闭保存。
请回答下列问题:
(1)实验步骤①的目的是 ,加热的作用是 。
(2)实验步骤②明显不合理,理由是 。
(3)实验步骤④中用少量冰水洗涤晶体,其目的是 。
(4)经查阅资料后发现,硫酸亚铁在不同温度下结晶可分别得到FeSO4·7H2O、FeSO4·4H2O和FeSO4·H2O。硫酸亚铁在不同温度下的溶解度和该温度下析出晶体的组成如下表所示(仅在56.7℃、64℃温度下可同时析出两种晶体)。
硫酸亚铁的溶解度和析出晶体的组成
|
温度/℃ |
0 |
10 |
30 |
50 |
56.7 |
60 |
64 |
70 |
80 |
90 |
||
|
溶解度/g |
14.0 |
17.0 |
25.0 |
33.0 |
35.2 |
35.3 |
35.6 |
33.0 |
30.5 |
27.0 |
||
|
析出晶体 |
FeSO4·7H2O |
FeSO4·4H2O |
FeSO4·H2O |
|||||||||
 请根据表中数据作出硫酸亚铁的溶解度曲线。
请根据表中数据作出硫酸亚铁的溶解度曲线。
(5)若需从硫酸亚铁溶液中结晶出FeSO4·4H2O,
应控制的结晶温度(t)的范围为 。
13.以富含硫酸亚铁的工业废液为原料生产氧化铁的工艺如下(部分操作和条件略):
Ⅰ.从废液中提纯并结晶出FeSO4·7H2O。
Ⅱ.将FeSO4·7H2O配制成溶液。
Ⅲ.FeSO4溶液与稍过量的NH4HCO3溶液混合,得到含FeC03的浊液。
Ⅳ.将浊液过滤,用90℃热水洗涤沉淀,干燥后得到FeC03固体。
ⅴ.煅烧FeCO3,得到Fe2O3固体。
已知:NH4HCO3在热水中分解。
(1)Ⅰ中,加足量的铁屑除去废液中的Fe3+,该反应的离子方程式是 。
。
(2)Ⅱ中,需加一定量硫酸。运用化学平衡原理简述硫酸的作用
。
(3)Ⅲ中,生成FeCO3的离子方程式是
。若FeCO3浊液长时间暴露在空气中,会有部分固体表面变为红褐色,该变化的化学方程式是 。
。
(4)IV中,通过检验SO42-来判断沉淀是否洗涤干净。检验SO42的操作是 
。
(5)已知煅烧FeC03的化学方程式是4FeCO3+O2  2Fe2O3+4CO2。现煅烧464.0 kg 的FeCO3,得到316.8 kg产品。若产品中杂质只有FeO,则该产品中Fe2O3的质量
2Fe2O3+4CO2。现煅烧464.0 kg 的FeCO3,得到316.8 kg产品。若产品中杂质只有FeO,则该产品中Fe2O3的质量 Kg。(摩尔质量/g·mol-1:FeCO3 116
Fe2O3 160 FeO 72)
Kg。(摩尔质量/g·mol-1:FeCO3 116
Fe2O3 160 FeO 72)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com