
25.答案:(1)过滤 萃取 Cl2+2I-===I2+2Cl- (2)B
(3)分液漏斗,锥形漏斗
(4)①缺石棉网,②温度计插到了液体中,③冷凝管进出水的方向颠倒;
(5)使蒸馏烧瓶均匀受热、控制加热温度不会过高 蒸馏烧瓶
解析:(1)从流程图中提示可知操作①是过滤;③是萃取;②中的反应是Cl2将I-氧化成I2的反应。
(2)根据萃取的原理,要从含碘的水溶液中萃取碘,所选择的萃取剂一定要和水互不相溶或很难相溶,而选项中,酒精、乙酸、甘油皆与水互溶,因此B是正确选项。
(3)按照流程图考虑每一步骤需要的仪器,还缺少锥形漏斗和分液漏斗。
(4)检验实验装置的错误,要按照实验的进程,逐一检查,通常是从左到右,自下而上。该装置中缺石棉网,温度计不应插入液体中,冷凝管出水的方向错了。
(5)利用水浴可使被加热物质受热均匀而温度又不会超过100℃,最后在蒸馏烧瓶中得到晶态碘。
●命题趋向与应试策略
24.答案:(1)先将浓硝酸注入容器中,再慢慢注入浓硫酸,并及时搅拌和冷却
(注:给分点是①次序②慢慢加入③及时搅拌)
(2)将反应器放在50℃-60℃(或60℃)的水浴中加热
(注:给分点是①水浴②60℃)
(3)分液漏斗
(4)除去粗产品中残留的酸(或除去残留的硝酸、硫酸)
(5)大 苦杏仁
23.答案:A:NaOH,B:NaNO3,C:Ba(NO3)2,D:HNO3,X:MgSO4
A:HNO3,B:NaNO3,C:Ba(NO3)2,D:NaOH,X:Na2SiO3
解析:从所给的A、B、C、D四种物质看,向其中加入某种试剂会产生白色沉淀的可做如下推理:硝酸钠溶液很难和其他物质在溶液中产生沉淀;氢氧化钠一般能和多种金属阳离子生成难溶性碱,其中常见的白色难溶性碱有氢氧化镁、氢氧化亚铁(空气中不易观察到)、氢氧化铝(两性);硝酸是一种强酸,其盐一般均可溶,所以在复分解反应中,硝酸除了能和硅酸盐形成难溶于水的硅酸(白色沉淀)外,很难和其余物质产生沉淀;能和硝酸钡形成沉淀的物质应主要从酸根阴离子考虑,如碳酸盐、亚硫酸盐、磷酸盐、硫酸盐等均能和硝酸钡形成白色沉淀,其中生成的硫酸钡是难溶于强酸的。
22.答案:(1)稀 (a)(c) (2)(a)(c)
(3)(b) Fe(OH)3、Cu(OH)2
解析:(1)由Ag+2HNO3(浓)===AgNO3+NO2↑+H2O,3Ag+4HNO3(稀)===3AgNO3+NO↑+2H2O,可以看出,消耗同样多的Ag时,浓HNO3放出NO2多,耗HNO3也多。
(2)加热主要是提高反应速率,使金属与HNO3在较短时间内充分反应,提高反应物的转化率。
(3)冲稀使溶液的pH增大,Fe3+、Cu2+以氢氧化物形式沉淀析出,从而除去了杂质。
21.答案:(1)FeI2 FeCl3 (2)C (3)升华 萃取
(4)将I2加在淀粉溶液中,溶液显蓝色
(5)2AgI===2Ag+I2
解析:分析物质的转化图,逐一分析讨论,可得出乙物质是由铁和碘化银反应生成的,由于铁在该反应中只能被氧化为+2价,故乙是FeI2,而不是FeI3,而Cl2将FeI2氧化为I2和FeCl3:3Cl2+2FeI2===2I2+2FeCl3
在第④步操作中用稀硫酸浸洗银时,是除去银里的少量铁。I2单质易升华,易溶于有机溶剂(如酒精、四氯化碳等),提纯I2可用升华和萃取的方法。单质I2遇淀粉的水溶液显蓝色,这是检验单质I2的常用方法(也是检验淀粉的常用方法)。AgI的稳定性较差,见光受热易分解生成单质银和碘。
20.答案:(1)2Cl--2e-==Cl2 升高
(2)Ca2++CO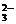 ===CaCO3↓
===CaCO3↓
Mg2++2OH-===Mg(OH)2↓
(3)ac (4)bc (5)蒸发 过滤
(6)NaCl+H2O NaClO+H2↑
NaClO+H2↑
或2NaCl+2H2O H2↑+Cl2↑+2NaOH
H2↑+Cl2↑+2NaOH
Cl2+2NaOH===NaCl+NaClO+H2O
解析:(1)与电源负极相连的电极,其反应为:2H++2e-===H2↑,促使H2O
H++OH-向右移动,产生大量OH-,pH升高。
(3)溶液中已有OH-、Cl-,如果加入Ba(NO3)2,即掺入了新的杂质NO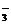 离子。
离子。
(4)欲有效除去三种离子,所加的三种试剂应过量,过量的Ba2+必须用CO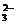 除去,所以加钡试剂必须在加Na2CO3之前。
除去,所以加钡试剂必须在加Na2CO3之前。
19.答案:(1)萃取(萃取、分液) 分液漏斗
(2)C6H5ONa NaHCO3
(3)C6H5ONa+CO2+H2O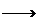 C6H5OH+NaHCO3
C6H5OH+NaHCO3
(4)CaCO3 过滤
(5)NaOH水溶液 CO2
解析:解答本题的关键是要看懂流程图到底给了我们哪些信息,是以何种方式给出的。
18.答案:(1)蒸馏法
(2)取一支小试管,打开分液漏斗的活塞,慢慢放出少量液体,往其中加入少量水,如果加水后,试管中的液体不分层,说明分液漏斗中,下层是“水层”,反之,则上层是水层。
解析:本题考查了混合物的分离原理和分离方法。分离沸点不同但又互溶的液体混合物,常用蒸馏的方法。分离互不相溶的液体混合物,常用分液的方法。
此题的难点是第二小题,这是一实验设计题,比较新颖,不少考生感到无从下手。实质上,解此题要紧扣水与有机物互不相溶这一分液原理,从分液漏斗中放出少量下层液体,再向放出的液体中加入水,如不分层,则证明下层是水。
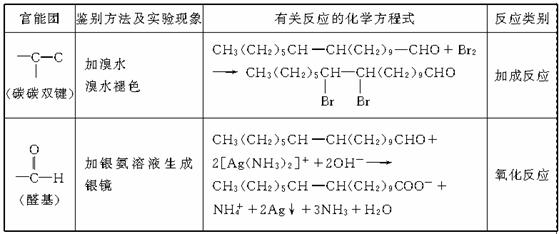
17.答案:
16.答案:D
解析:对各组溶液,分别采用两两混合法进行区分。D组中,硫酸镁遇氢氧化钾、碳酸钾均有白色沉淀,则硫酸镁、硫酸氢钾得以鉴别;再用硫酸氢钾与两个待检液反应,有气体产生的是碳酸钾,余下的是氢氧化钾。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com