
3.化学性质
(1)氨与水反应
[思考] ①氨水中存在哪些微粒?(完成下列离子方程式)
I足量氨水与氯化铝溶液 II足量氨水与硝酸银溶液
②5、将25%的氨水和5%的氨水等体积混合,所得氨水溶液的质量分数 ( )
A、等于15% B、大于15% C、小于15% D、无法估算
③已知液氨有极微弱的导电性,试写出它的电离方程式 _______________ 。
[例6]下列事实可证明氨水是弱碱的是 ( )
A.氨水能跟氯化亚铁溶液反应生成氢氧化亚铁 B.铵盐受热易分解
C.0.1 mol•L-1氨水可以使酚酞试液变红 D.0.1 mol•L-1氯化铵溶液的PH约为5
(2)氨与酸反应
(3)氨的还原性
①催化氧化 ②与氯气
③与氧化铜
2.物理性质:
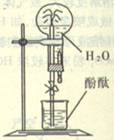 氨是没有颜色、有______气味的气体;易液化,密度比空气____;___溶于水且能快速溶解,在常温、常压下1体积水能溶解____体积氨。证明氨极易溶于水的实验是_____。
氨是没有颜色、有______气味的气体;易液化,密度比空气____;___溶于水且能快速溶解,在常温、常压下1体积水能溶解____体积氨。证明氨极易溶于水的实验是_____。
[实验]书本P99氨的喷泉实验,回答下列问题:
①为什么会产生此种现象?
②实验结束后最后得到的是 溶液其浓度为 mol/L(标况下)
③还有哪些组合能形成喷泉?
1.分子结构:结构式 __________ ,电子式 __________ ,分子构型________,键角_____ N-H键为_____键(极性或非极性,下同),NH3为_________分子。
1. NH3+O2 2.NO+O2 3. NO2 + H2O
注意: 氨氧化生成的NO由于反复氧化,所以原料氨气与产物硝酸的计算关系式理论应为NH3 : HNO3 = 1 : 1
[例5]某工厂用NH3制备NH4NO3,已知:由NH3制NO的产率为96%,NO2制HNO3的产率为92%,HNO3跟NH3反应生成NH4NO3,则制HNO3所用去的NH3的质量占总耗NH3质量(不考虑生产上的其它损耗)的______________________________。
3.硝酸的工业制法及用途(课本P102)
2.化学性质(完成化学方程式)
(1)强酸性:
(2)不稳定性 : HNO3 。(硝酸如何保存?)
(3)强氧化性(与金属反应不放出H2)
①浓硝酸使Fe、Al钝化。
Fe + HNO3(过量、浓) 。
②C + HNO3(稀) 。
③FeS + HNO3(稀) 。
注意:在中性、碱性溶液中NO3-几乎与所有离子能大量共存,但在酸性较强时NO3-与某些还原性的离子不能大量共存。
[例4]在浓硝酸中放入Cu片:
①开始反应时的化学方程式___________________________________________。
②若Cu有剩余,则反应将要结束时的化学方程式_________________________。
③待反应停止后,加入25%的稀硫酸,这时Cu片上又有气泡产生,原因是_________。
④若将12.8gCu跟一定量的浓硝酸反应,Cu耗完时,共产生气体5.6L(标况)。则所消耗的硝酸的物质的量是________。所得气体的平均相对分子质量是 __ _。
1.物理性质: 纯硝酸是 、 气味的液体,能跟水 互溶,常用浓硝酸的质量分数大约为 常用浓硫酸、浓盐酸质量分数分别 和 。
4.NO、NO2的制取
①实验室制取NO的化学方程式为__________________________;用______法收集。
②实验室制取NO2的化学方程式为_________________________;用______法收集。
[例3]铜和浓硝酸反应和铜与稀硝酸反应,产物不同,实验现象也不同 .
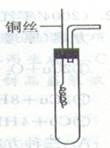 (1).某课外活动小组为了证明并观察到铜与稀硝酸反应的产物为NO,设计了如图所示的实验装置,请你根据他们的思路,选择下列药品,完成该实验,并叙述实验步骤:
(1).某课外活动小组为了证明并观察到铜与稀硝酸反应的产物为NO,设计了如图所示的实验装置,请你根据他们的思路,选择下列药品,完成该实验,并叙述实验步骤:
药品:稀硝酸 稀盐酸 锌粒 石灰石固体
步骤:①检查装置的气密性
② ;
③
④
⑤
⑥用注射器向广口瓶内推入氧气(或空气)
(2)推入氧气或空气的目的是 ;
(3)分别将等质量的铜片与等体积均过量的浓硝酸和稀硝酸反应,所得到的溶液前者呈绿色,后者呈蓝色,某同学提出,这可能是Cu2+浓度差异引起的,你同意这种看法吗?
(填同意或不同意),原因是
另一位同学提出溶液呈绿色是Cu2+与NO2混合的结果,请你设计一个实验证明之(简述实验方案和实验现象).
3.氮的氧化物溶于水计算的有关化学方程式
NO + O2 + H2O ─ NO2 + O2 + H2O ─
[例2]将盛有12mLNO2和O2的混合气体的量筒倒立于水槽中,充分反应后,还剩余2mL无色气体,则原混合气体中O2的体积是 ( )
A、1.2mL B、2.4mL C、3.6mL D、4mL
2、 NO、NO2的性质:(完成下列化学方程式)
① NO和氧气的反应:_____________________________,
② NO2和N2O4的相互转化:______ ____,故通常“纯净”的NO2或 N2O4并___纯。
③NO2和水反应:________________________。
④NO2和NaOH溶液反应:_______________________。
⑤硝酸工业用NaOH吸收尾气:_________________________。
⑥NO2具有较强的氧化性,能______SO2;能使湿润的淀粉KI试纸______。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com