
4.D [解析]“既要提高溶液中HClO物质的量浓度,又要降低溶液中HCl浓度”,即要通过消耗HCl来实现提高溶液中HClO物质的量浓度。用NaOH能同时消耗HClO,不可。HClO的酸性弱与碳酸,所以可以用CaCO3。
3.D [解析]由水电离产生的氢离子与氢氧根离子浓度相等,所以为10-14mol/L。溶液可能为强酸性也可能为强碱性。A项在碱性溶液中不能大量共存;B项中的SO32-在酸性溶液中不能大量共存,C项中的MnO4-在酸性溶液中可以氧化Fe2+。
2.B [解析]当溶液pH相等时,醋酸的浓度大于盐酸的浓度,当溶液稀释时,浓度的变化也相同,所以醋酸的浓度仍然大于盐酸的浓度。注意点:本题考查的是浓度的大小,并非pH的变化。
1.B [解析]在水中加入酸或碱都抑制水的电离,强酸强碱盐不影响水的电离,强酸弱碱盐或强碱弱酸盐都可以水解而促进水的电离。
2.现有常温下的0.1mol·L-1纯碱溶液。
⑴你认为该溶液呈碱性的原因是(用离子方程式表示):
为证明你的上述观点,请设计一个简单的实验,简述实验过程:
⑵同学甲认为该溶液中Na2CO3的水解是微弱的,发生水解的CO32-离子不超过其总量的10%。请你设计实验证明该同学的观点是否正确。
⑶同学乙就该溶液中粒子之间的关系写出了下列四个关系式,你认为其中正确的是
A.c(Na+)=2c(CO32-) B.c(CO32-)>c(OH-)>c(HCO3-)>c(H2CO3)
C.c(CO32-)+c(HCO3-)=0.1mol·L-1 D.c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)
⑷水解反应是典型的可逆反应。水解反应的化学平衡常数称为水解常数(用Kh表示),
请写出Na2CO3第一步水解反应的水解常数的表示式:
㈢简答题:
⑴实验室中不少试剂瓶的标签外都涂有一层石蜡,其作用是_ _____________ ____________________________________;在取用酚酞试液时往往会闻到一股明显的酒精的特殊香味,你觉得有可能的原因是 。
⑵苯酚(C6H5OH)显弱酸性,水溶性不好,它分散于水中往往形成浊液。在C6H5ONa溶液中通入CO2后会生成C6H5OH,从而出现浑浊。试设计一个简单的实验证明C6H5ONa与CO2的另一反应产物是NaHCO3而不是Na2CO3。(说明:NaHCO3在溶液受热不易分解,且它能与CaCl2溶液反应能生成CaCO3沉淀。)
(只须写出简要的实验步骤和文字说明)
解析答案:
㈠选择题:
1.已知水在25℃和95℃时,其电离平衡曲线如右图所示:
⑴则25 时水的电离平衡曲线应为 (填“A”或“B”),请说明理由 。
⑵25时,将=9的NaOH溶液与=4的溶液混合,若所得混合溶液的 =7,则NaOH溶液与溶液的体积比为 。
⑶95时,若100体积1=的某强酸溶液与1体积2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是 。
⑷曲线B对应温度下,pH=2的某HA溶液和pH=10的NaOH溶液等体积混合后,混合溶液的pH=5。请分析其原因: 。
6.下列有关叙述正确的是
A.在中和滴定中,既可用标准溶液滴定待测溶液,也可用待测溶液滴定标准溶液
B.进行中和滴定操作时,眼睛要始终注视滴定管内溶液液面的变化
C.测定中和热时,两烧杯间填满碎纸的作用是固定小烧杯
D.若用50mL 0.55mo1·L-1的氢氧化钠溶液,分别与50mL 0.50mo1·L-1的盐酸和50mL 0.50mo1·L-1的硫酸反应充分反应,两反应的中和热不相等
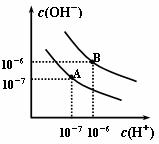 ㈡填空题
㈡填空题
5.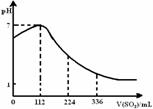 某同学向100mL氢硫酸溶液中通人标准状况下的二氧化硫气体,所得溶液pH变化如图所。他据此得到的下列四条关于二氧化硫和亚硫酸的说法。请分析其中正确的是
某同学向100mL氢硫酸溶液中通人标准状况下的二氧化硫气体,所得溶液pH变化如图所。他据此得到的下列四条关于二氧化硫和亚硫酸的说法。请分析其中正确的是
A.SO2 是弱电解质
B.H2SO3不是强酸
C.亚硫酸是比氢硫酸还弱的酸
D.原氢硫酸溶液的物质的量浓度0.05mo1·L-1
4.现用氯水来制取含有次氯酸的溶液,既要提高溶液中HClO物质的量浓度,又要降低溶液中HCl浓度,下列措施可以采用的是
A.加热挥发HCl B.加水使平衡向正反应方向移动
C.加NaOH中和HCl D.加CaCO3 中和HCl
3.在常温下某化合物的水溶液中,已知由水电离出来的以c (H+)和c(OH-)分别为a mol·L-1 和b mol · L-1 ,且 a·b =10-28 ,下列离子组在该溶液中一定能大量共存的是
A.Al3+、 NH4+、 SO42-、 Cl- B.N+、 K 十、SO42- 一、SO32
C.K 十、 Fe2+、 Cl- 、 MnO4- D.Ba2+、 Na+、 Cl- 、 NO3-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com