
4.函数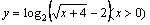 的反函数是( )
的反函数是( )
A.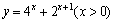 B.
B.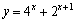 (x∈R)
(x∈R)
C.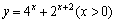 D.
D.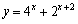 (x∈R)
(x∈R)
3.已知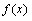 =
=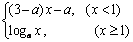 是(-∞,+∞)上的增函数,那么a的取值范围是( )
是(-∞,+∞)上的增函数,那么a的取值范围是( )
A.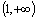 B.
B.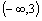 C.
C.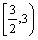 D.(1,3)
D.(1,3)
2.已知x∈R, 则“
则“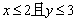 ”是“
”是“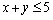 ”的( )
”的( )
A.充分不必要条件 B.必要不充分条件
C.充要条件 D.既不充分又不必要条件
1.函数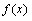
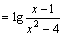 的定义域为( )
的定义域为( )
A.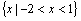 B.
B.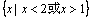
C. D.
D.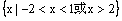
3.重视化学学科的规律,实现知识的正迁移
我们学习的知识以及在学习知识的过程中积累的学习方法和经验,很大程度上是为了积累一些解决问题的方法,即形成对知识的迁移能力。如果不会迁移,无论知识掌握多少,都是无用的死知识。
2.深入剖析题给条件,免入歧途
命题者为了更好地考查我们敏捷而严密的思维能力,常常在题中设置一些误导条件、过剩条件、隐含条件等,若不深入剖析题给条件,很可能会使思路误入歧途,得出与实际不相符的答案。
1.排除定势思维的干扰,透过现象看本质
对于离子在溶液中的存在状态的判断,很多学生把离子的水解与离子浓度大小的情况混淆,其实离子的水解或弱电解质的电离都是比较弱的,所以对于溶液中本身能够电离产生的离子浓度均是最大的。
1.[答案]⑴ A ;水的电离是吸热过程 ,温度低时,电离程度小,c(H+)、c (OH-)小
⑵ 10 : 1 ⑶ +b=14 或:pH1 + pH2 =14
⑷曲线B对应95℃,此时水的离子积为10-12。HA为弱酸,HA中和NaOH后,混合溶液中还剩余较多的HA分子,可继续电离出H+,使溶液pH=5。
[解题思路]本题的关键是在搞清楚温度对水电离平衡、水的离子积和溶液pH的影响。
⑴当温度升高时,促进水电离,水的离子积也增大,水中氢离子浓度、氢氧根离子浓度都增大,水的pH也增大,但溶液仍然呈中性。因此结合图象中A、B曲线变化情况及氢离子浓度、氢氧根离子浓度可以判断则25 时水的电离平衡曲线应为A,理由为水的电离是吸热过程,升高温度,使水的电离程度增大。
⑵中25时所得混合溶液的 =7,溶液呈中性即酸碱恰好中和,即n(OH-)= n(H+),则V(NaOH)·10-5mo1·L-1=V(H2SO4)·10-4mo1·L-1,得V(NaOH)∶V(H2SO4)=10∶1
⑶要注意是95时,水的离子积为10-12,即c(H+)·c(OH-)=10-12,即:等体积强酸碱反应至中性时(酸)+(碱)=12。
根据95时混合后溶液呈中性,2=b的某强碱溶液中c(OH-)=10b-12;有 100×10-a=1×10b-12,即: 10-a+2=10b-12,所以,有以下关系:+b=14,或:pH1 + pH2 =14
⑷中在曲线B对应温度下,因(酸)+(碱)=12,可得酸碱两溶液中c(H+) = c(OH-),如 是强酸、碱,两溶液等体积混合后溶液应呈中性;现混合溶液的pH=5,即等体积混合后溶液显酸性,说明H+与OH-完全反应后又有新的H+产生,酸过量,所以说酸HA是弱酸。
[答案]⑴ CO32-+H2OHCO3-+OH- ;
向纯碱溶液中滴加数滴酚酞试液后,溶液显红色;然后逐滴加入氯化钙溶液直至过量,若溶液红色逐渐变浅直至消失,则说明上述观点。
⑵用pH试纸(或pH计)测常温下0.1mol·L-1纯碱溶液的pH,若pH<12,则该同学的观点正确;若pH>12,则该同学的观点不正确。
⑶ B、D ⑷ Kh=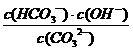
[解题思路]
⑴纯碱是盐不是碱,其溶液呈碱性的原因只能是盐的水解。
证明的出发点是:把产生水解的离子消耗掉,看在无水解离子的情况下溶液是否发生变化。
⑵离子是微观的,发生水解的量是看不到的,但水解后的结果――溶液酸碱性和酸碱度是可以测量的,所以可用测溶液pH的方法来测定“水解度”。
⑶A式c(Na+)=2c(CO32-) 方程式两边分别是正负电荷,所以考虑电荷守恒。因为缺少HCO3-而错误。 B式是离子浓度大小排序:c(CO32-)>c(OH-)>c(HCO3-)>c(H2CO3),要从水解程度大小来考虑,正确。要说明的是:HCO3-水解的程度大于其电离的程度。 C式c(CO32-)+c(HCO3-)=0.1mol·L-1右边是溶液浓度,因此考虑原子守恒,但由于疏漏碳酸,错误。 D式c(OH-)=c(H+)+c(HCO3-+2c(H2CO3)一边是水解产物之一OH-,一边是水解的另一产物,所以考虑物料守恒,考虑它们之间量的比例关系,D正确。
⑷CO32-第一步水解的离子方程式CO32-+H2OHCO3-+ OH-,先按照化学平衡常数的书写方式得:K=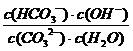 ,再根据平衡常数的书写规则:在稀溶液中水的浓度视为1 ,参考水的离子积的表达方式,得水解常数表达式:Kh=
,再根据平衡常数的书写规则:在稀溶液中水的浓度视为1 ,参考水的离子积的表达方式,得水解常数表达式:Kh=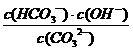 。
。
㈢简答题:
⑴把小块pH试纸放在表面皿(或玻璃片)上,用蘸有待测溶液的玻璃棒点在试纸的中部,试纸变色后,与标准比色卡比较来确定溶液的pH CO32-+H2O HCO3-+OH-
HCO3-+OH-
7到13
⑵向纯碱溶液中滴入酚酞溶液,溶液显红色;若再向该溶液中滴入过量氯化钙溶液,
产生白色沉淀,且溶液的红色褪去。说明纯碱溶液呈碱性是由CO32-引起的。
6.A [解析]本题考查中和热的测定和中和滴定实验的有关操作和目的。该实验是一个定量实验,定量实验取关键之处就是减小误差,所以,在中和滴定实验的滴定过程中,眼睛要始终注视锥形瓶内溶液的颜色变化,B选项错误;中和滴定是通过指示剂来指示滴定终点,通过对测定数据的计算来确定待测液的浓度,故只要能满足上述条件,则与滴加顺序无关,A正确。测中和热时,两烧杯间填满碎纸的作用是首先是保温,减少热量损失;中和热是以生成1mol水为基准,中和反应的中和热均为放出57.3kJ/mol,而与酸碱的用量无关,故C、D均错误,
㈡填空题:
5.B [解析]二氧化硫不是电解质,A错;从图上看,在224mL时,0.05 mol·L-1的亚硫酸的pH远小于1,说明它是弱酸,B正确;根据方程式:2H2S+SO2=3S+2H2O得,原氢硫酸溶液的物质的量浓度0.1mo1·L-1,D错;从图中看出,同浓度的亚硫酸比氢硫酸的pH小,则其酸性比氢硫酸的要强,C错。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com