
[题7](2010年高考安徽卷理科10)设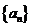 是任意等比数列,它的前
是任意等比数列,它的前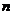 项和,前
项和,前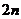 项和与前
项和与前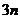 项和分别为
项和分别为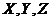 ,则下列等式中恒成立的是
,则下列等式中恒成立的是
A、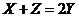 B、
B、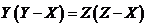
C、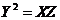 D、
D、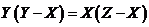
[分析]这道题如果坚持从通法入手将是十分困难的.可是如果选用特值,则相当简单.
[解析1]取等比数列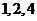 ,令
,令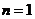 ,则其前n项,前2n项,前3n项和依次为
,则其前n项,前2n项,前3n项和依次为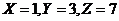 .代入验算,只有
.代入验算,只有 选项D适合,故选D.
选项D适合,故选D.
R:在我们那里,这种纯粹利用数字代替得到的答案,被认为是有投机取巧之嫌的.古老师怎么看呢?
古:对于四选一的选择题,这种解法完全合理.在题设4个选项中,不论用什么手段,只要能够否定其中的3个,第4个就必然正确.
当然,在平时讲课时,为了解除学生对答案的疑虑,我们还会与他们探讨正面的证法.
[解析2]以上用特值法得到的结论证明如下:
设此等比数列前n项和为a,次n项和为b,再n项和为c,那么a,b,c也成等比数列,即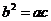 .
.
∵X=a,Y=a+b,Z=a+b+c,∴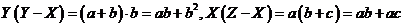
已证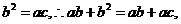 即
即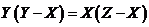 成立.
成立.
Q:古老师讲的这两道题又是选择题.如果是填空题,无选项可以否定,特值法还有效吗?
古:这方面的例子也很多.最突出的是05年的一道考题:
[题8]如图1,直三棱柱ABC-A1B1C1中,P,Q分别是侧棱AA1,CC1上的点,且A1P=CQ,则四棱锥
B1-A1PQC1的体积与多面体ABC-PB1Q的体积比值为 .
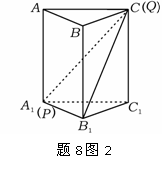
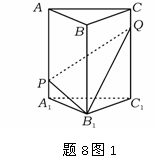
解法:取特值0.如题8图2.令A1P=CQ=0.则多面体蜕变为四棱锥C-AA1B1B,四棱锥蜕化为三棱锥C-A1B1C1. 显然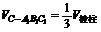 ,∴
,∴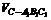 :
: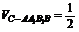 .
.
这道题如果强调用通法去做,大概只能实行割补了,其计算量又大又笨重,何苦一定让学生去遭这份罪呢?
R:这道题虽然好,可惜不是数列题.请教古老师,如下这题也能够用特值法吗?
[题9](2010.南通小题训练)在等差数列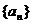 中,
中,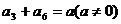 ,
,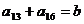 ,则
,则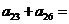 .
.
古:这道题我曾经给学生讲过.我的解法是:
[解析]考察题目的条件,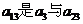 的等差中项,
的等差中项,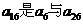 的等差中项,
的等差中项,
∴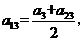 得
得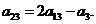 同理:
同理: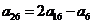 .于是
.于是
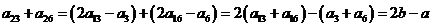 .
.
我自认为这个解法是很妙的.不想一个学生的表情异样,似乎不屑一顾的样子.我知道他必定有话要说.就鼓励他发言.她说:“既然是一道小题,何必这样正儿八经地去解?不妨设这个等差数列的通項为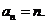 .那么
.那么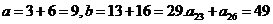 .比较3个数据,
.比较3个数据,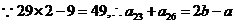 .”
.”
这种解法我事先的确不曾想到.于是我问她:你是用特值法做的,你的结论只能算是一种猜想.你就不担心你会猜错吗?
P,Q,R(十分感兴趣地)急问:她怎么说?
古:她语出惊人:题目给出的条件是等差数列,那么它的结论对一切等差数列都应该适用.假如我取特值由这个简单的等差数列得到的结论反而错了,那说明题目本身就有问题.
P:以下是2010年高考天津卷理科6题及有人在网上提出的解法.请教古老师,你认为这个解法合理吗?
[题10]已知{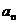 }是首项为1的等比数列,
}是首项为1的等比数列,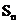 是{
是{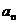 }的前n项和,且
}的前n项和,且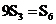 。则数列
。则数列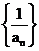 的前5项和为
的前5项和为
(A)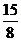 或5 (B)
或5 (B)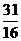 或5 (C)
或5 (C)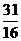 (D)
(D)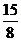
[解析]设等比数列的公比为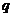 ,则当公比
,则当公比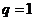 时,由
时,由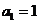 得,
得,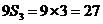 ,而
,而
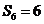 ,两者不相等,故不合题意;当公比
,两者不相等,故不合题意;当公比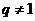 时,由
时,由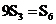 及首项为1得:
及首项为1得:
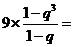
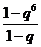 ,解得
,解得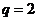 ,所以数列
,所以数列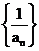 的前5项和为
的前5项和为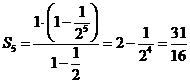 ,故选C。
,故选C。
古:这种解法还是通法,总体上也说得过去.但是存在如下2个弱点,1.进行了可以避免的讨论;2.仅求前5项和,而两次使用了求和公式,所以解法过繁,质量不算高.以下的解法是否更好些?
[解析2]设此等比数列前3项和为a,次3项和为b,那么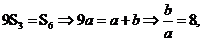 即
即 ,已知{
,已知{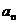 }的首项为1,所以数列
}的首项为1,所以数列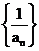 的前5项和为
的前5项和为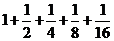 =
=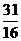 ,选C。
,选C。
P:古老师的解法不仅计算简单,还无须进行讨论.特技的优越性可见一斑.
Q: 2010.天津一中四月考的第4题及有人提供的解法是:
[题11]设等差数列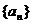 的前n项和为
的前n项和为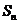 ,若
,若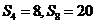 ,则
,则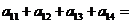 ( )
( )
A.18 B.17 C.16 D.15
[解析1]设这个等差数列的公差为d,那么:
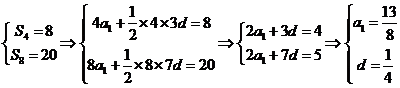
∴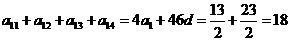 ,故选A.
,故选A.
请教古老师,解这样的题也能够使用特技吗?
古:这种解法还是通法,也比较简便.不过一道好题总是有题外之意,弦外之音的.继续发掘不仅可以最大限度地发挥它的能量,还能提升学生的解题能力.以下解法,仅供参考.
[解析2]这个数列连续4项的和组成的数列还是等差数列.设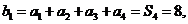
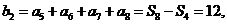 则
则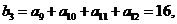
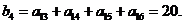
注意到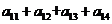 是
是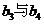 的等差中项,故
的等差中项,故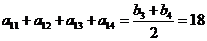 ,选A.
,选A.
R:古老师的教学模式,总是先通法,再特技吗?
古:就数学教学而言,仅有以上两步是不够的,还需要培养学生寻根建模的能力.
在数学解题中,我们将那些源于基础,又高于基础,还有广泛应用价值的优秀试题称为题根.
每一个数学题根及其解题思想方法,都能够成为一种有效的解题模型.
不过,这应该是另一个专题的内容,以后有机会时再与各位探讨吧.
P:今天我们受益非浅,最后请万校长作一个总结吧.
万:今天主要与各位讨论通法与特技之间的关系.我们的看法是:
1.通性通法主要体现共性, 特技术特法则主要体现个性. 世间万物包括数学在内,正因为有了个性才得以千姿百态,丰富多彩. “一花独放不是春,百花开放春满园”.所以淡化特殊技巧的提法,我们以为是不妥的.
16、(2010·三明模拟)为了探究Cl2、SO2同时通入H2O中发生的反应,某校化学兴趣小组同学设计了如下图所示的实验装置。
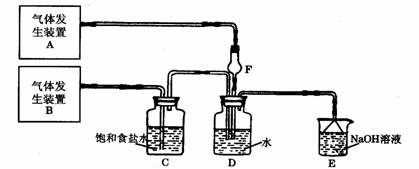
(1)气体发生装置A产生的气体是 ;
(2)为验证通入D装置中的气体是Cl2过量还是SO2过量,某小组同学准备了以下试剂:
① 氯化铁溶液 ② 氯化亚铁溶液 ③ 硫氰化钾溶液
④ 苯酚溶液 ⑤ 品红溶液 ⑥ 酸性高锰酸钾溶液
I 若Cl2过量:取适量D中溶液滴加至盛有 (选填一个序号)试剂的试管内,再加入 (选填一个序号)试剂,实验现象是: ;
II 若SO2过量:取适量D中溶液滴加至盛有 (选填一个序号)试剂的试管内,实验现象是: ;
(3)另一小组设计如图所示的装置图(图中夹持和加热装置略去),分别研究SO2和Cl2的性质。
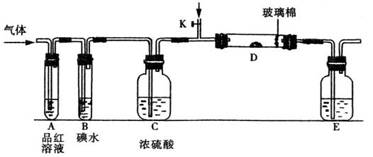
①若从左端分别通入SO2和Cl2,装置A中观察到的现象是否相同? (填“相同”或“不相同”);
②若装置B中装有5.0 mL 1.0mol/L碘水,当通入足量Cl2完全反应后,共转移了5.0×10-2mol电子,该反应的化学方程式为 。
(4)若由元素S和O组成-2价酸根离子X,X中S和O的质量比为4∶3;当Cl2与含X的溶液完全反应后,有浅黄色沉淀产生,取上层清液加入氯化钡溶液,有白色沉淀产生。写出Cl2与含X的溶液反应的离子方程式
[解析](1)气体发生装置B产生的气体经过饱和食盐水后才进入装置,说明气体发生装置B产生的气体
是Cl2,气体发生装置A产生的气体是SO2。
(2)I 若Cl2过量:取适量D中溶液滴加至盛有氯化亚铁溶液的试管内,再加入硫氰化钾溶液(或苯酚
溶液),溶液呈血红色(或紫色);
II 若SO2过量:取适量D中溶液滴加至盛有酸性高锰酸钾溶液的试管内,溶液变成无色
[答案](1) SO2
(2)I ② ③(或④) 溶液呈血红色(或紫色)
II ⑥ 溶液变成无色
(3) ①相同 ;
②5Cl2+I2+6H2O═2HIO3+10HCl
(4)S2O32-+Cl2+H2O═SO42-+S↓+2Cl-+2H+
()
15、(2010·大连模拟)下图表示有关物质(均是中学化学常见的物质)之间的转化关系(其中部分参加反应的水和生成的水未列出),其中B、C为金属单质,E为非金属单质,其余均为化合物,Y、Z的组成元素相同,D为淡黄色的固体。回答系列问题:
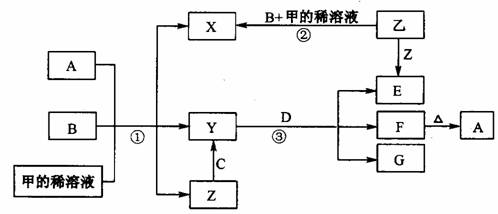
(1)B与甲稀溶液不反应,但与甲的浓溶液在加热条件下能反应。则甲为 ,C为 (填
写化学式)。
A与B物质的量应满足的关系为 。
(2)写出反应③的化学方程式 。
(3)反应②观察到溶液由无色变成蓝色,并且有无色气泡产生。请写出反应②发生的化学反应方程式 ,并分析产生气体的原因
[答案](1)H2SO4 Fe n(A):n(B)≥1:1
(2)4FeSO4+4Na2O2+6H2O=4Fe(OH)3+4Na2SO4+O2↑
(3)Cu+H2O2+H2SO4=CuSO4+2H2O 2H2O2=2H2O+O2↑ Cu2+催化H2O2分解
14、(2010·漳州模拟)将足量的铜片与一定量的浓硫酸共热反应,会不会出现随反应的进行硫酸浓度变稀而使反应停止,最终铜和硫酸都有剩余?某研究性学习小组按下图定性实验简易装置进行实验探究,部分现象如下:
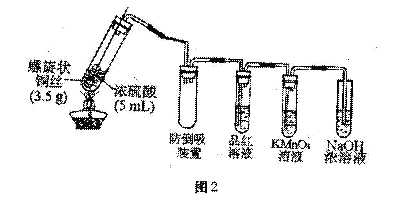
观察到:开始加热(浓硫酸未沸腾)时铜表面由光亮变黑,且黑色小颗粒扩散到浓硫酸中,并不断增多,当浓硫酸加热至沸腾时,黑色小颗粒逐渐溶解,溶液呈浅蓝色,继续加热时浅蓝色溶液逐渐变为灰白色悬浊液,液体量越来越少,最后全部变为灰白色固体。
查资料:①浓硫酸沸腾温度为338℃,这是硫酸和水的恒沸点温度。②胆矾失去全部结晶水温度为150℃.
请回答:(1)写出灰白色固体化学式
(2)反应过程中,可观察到品红溶液、KMnO4溶液褪色,这分别体现反应产生气体的 、
性质,其中气体与KMnO4溶液反应离子方程式:
(3)由上分析知:铜与浓硫酸共热,浓硫酸浓度 (填“会”或“不会”)变稀,因此 (填“会”或“不会”)出现反应自动停止,最终铜和硫酸都有剩余的现象。
(4)由上结论计算:将5ml 98%(密度为1.84g/cm3)的浓硫酸与足量的铜共热反应,产生气体的物质的量为( )
A.0.092mol B.0.046 mol C.小于0.046 mol D.大于0.046 mol,小于0.092 mol
[答案](1)CuSO4
(2)漂白性 还原性 5 SO2 + 2 MnO4- + 2 H2O = 5 SO42- + 2 Mn2+ + 4 H+
(3)不会,不会。
(4)B
13、(2010·昆明模拟)某同学用如图一所示的装置来探究CO2、SO2与澄清石灰水的反应,结果通入CO2可以看到先浑浊后澄清的现象,但通入SO2没有看到浑浊现象。经过思考分析,该同学改用图二的装置,将气体收集在注射器中,缓慢地将气体一个气泡一个气泡地通入澄清石灰水中,结果都能看到石灰水先变浑浊再澄清的现象,且通入SO2产生的现象明显比通入CO2快。
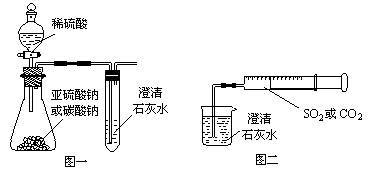
(1)若锥形瓶内装的是亚硫酸钠,写出锥形瓶内反应的化学方程式:______________
______________________________。
(2)对比分析两组实验,你认为用图一装置实验时,通入SO2不能出现浑浊的原因可能是_________________。写出此时试管内发生反应的总化学方程式:_____________________。
(3)用图二装置实验时,以相同速率通入CO2或SO2,SO2产生浑浊再变澄清的现象比CO2快,其原因是____________________________________。
(4)用图一进行SO2与石灰水反应的实验时,为防止SO2污染空气,应用盛有过量浓烧碱溶液的容器吸收SO2,写出容器内发生反应的离子方程式:_______
[解析] CO2跟石灰水反应生成白色沉淀CaCO3,SO2跟石灰水反应生成白色沉淀CaSO3,当气体过量时白色沉淀又溶解,所以,一般认为不能用石灰水来区别CO2和SO2。然而本题给出的结论是:通入SO2没有看到浑浊现象。这要从CO2和SO2性质的区别上来分析原因,二者在水中的溶解度及对应酸的酸性不同。防止SO2污染空气,要增加尾气吸收装置,烧碱过量时生成的盐为Na2SO3。
[答案](1)Na2SO3+H2SO4=Na2SO4+H2O+SO2
(2)反应时直接生成了酸式盐而看不到沉淀 Ca(OH)2+2SO2=Ca(HSO3)2
(3)SO2溶解度大,且对应的亚硫酸酸性比碳酸强,通入的SO2与石灰水反应快
(4)SO2+2OH-=SO32-+H2O
12、(2010·惠州模拟)下列制取硫酸铜的实验设计中,能体现“经济、高效、环保”精神的最佳方案是( )
A.铜与浓硫酸供热
B.用铜片为阳极,石墨为阴极,电解稀硫酸
C.先灼烧废铜屑生成氧化铜,然后再用浓硫酸溶解
D. 适当温度下,使铜片在持续通入空气的稀硫酸中溶解
[解析]选D。本题考查实验设计,较易题。由反应原理可知,选项D符合条件。
0.2mol 7.8g
当NaOH完全反应时,所得无水物质量应在(7.8-11.2)g之间,现在是7.9g,说明NaOH完全反应时,既有Na2S又有NaHS;当NaOH没有完全反应时,所得盐必有Na2S,所以综合以上两种情况,一定有Na2S。
0.2 mol 0.2 mol×56g/mol=11.2g
2 NaOH+H2S=Na2S+2H2O
2 mol 78g
11、(2010·南京模拟)含8.0gNaOH的溶液中通入一定量H2S后,将得到的溶液低温小心蒸干,称得无水物7.9g,则该无水物中一定含有的物质是( )
A.Na2S B. NaHS
C. Na2S和NaHS D. NaOH和NaHS
[解析]选A。NaOH+H2S=NaHS+H2O
1 mol 56g
10、(2010·深圳模拟)以水为溶剂进行中和滴定的原理是:H3O++OH-====2H2O。已知液态SO2和纯水的导电性相近,因为液态SO2也能发生自电离:2SO2=SO32-+SO2+;△H>0。下列叙述中,错误的是( )
A.若以液态SO2为溶剂,用SOCl2滴定Na2SO3,该滴定反应可以表示为:SO32-+ SO2+=2SO2
B.在一定温度下,液态SO2中c(SO32-)与c(SO2+)的乘积是一个常数
C.液态SO2中自电离的存在,说明SO2是离子化合物
D.适当升高温度,液态SO2的导电能力增强
[解析]选C。由信息得知SO2与H2O性质相似,为共价化合物。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com