
5.(2008年江苏高考第12题)下列溶液中有关物质的量浓度关系正确的是
A.pH=2的HA溶液与pH=12的MOH溶液任意比混合:
c(H+) + c(M+) == c( ) + c(
) + c(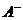 )
)
B.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:
c(NaOH)<c(CH3COONa)<c(Na2CO3)
C.物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合:
c(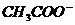 ) +2c(
) +2c( ) == 2c(H+)
+ c(CH3COOH)
) == 2c(H+)
+ c(CH3COOH)
D.0.1mol·L-1的NaHA溶液,其pH=4:c(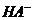 )>c(H+)>c(H2A)>c(A2-)
)>c(H+)>c(H2A)>c(A2-)
[答案]A、C
[解析]选项A中无论酸HA与碱MOH强还是弱,反应后的溶液中总存在四种离子,根据电荷守恒,A正确,选项B中NaOH是强碱,电离呈碱性,CH3COONa和Na2CO3两种溶液是水解呈碱性,水解的程度很小,若PH相同的,所需要两者的物质的量浓度远大于NaOH溶液,而且酸越弱水解的程度越大,所需要浓度就越小c(NaOH)<c(Na2CO3)<c(CH3COONa)
选项C中存在电荷守恒c(H+)
+ c(Na+) == c( ) + c(
) + c(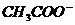 ),另不管溶液是电离还是水解,由于物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合,所以2c(Na+) == c(CH3COOH) + c(
),另不管溶液是电离还是水解,由于物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合,所以2c(Na+) == c(CH3COOH) + c(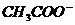 ),把后面的等式代入到第一个等式中,则C正确,D选项是溶液呈碱性,酸式盐的水解大于电离的等式若酸式盐呈碱性电离大于水解就不成立了,D错误
),把后面的等式代入到第一个等式中,则C正确,D选项是溶液呈碱性,酸式盐的水解大于电离的等式若酸式盐呈碱性电离大于水解就不成立了,D错误
规律:
(1)相同PH值的不同物质的浓度比较,若呈碱性则是强碱<弱碱<水解呈碱性的盐,水解程度大的盐<水解程度小的盐(呈酸性的顺序也可以同理推出)
(2)多元弱酸的酸式盐溶液NaHA,呈酸性与呈碱性时的不同是水解产物与电离产物的排序,还有就是H+与OH-的排序,如水解大于电离则c(H+)>c(H2A)>c(A2-),若电离大于水解则c( )>c(A2-)>c(H2A)。
)>c(A2-)>c(H2A)。
4.(2008年天津理综第9题)醋酸溶液中存在电离平衡:
CH3COOH H++CH3COO-,下列叙述不正确的是
( )
H++CH3COO-,下列叙述不正确的是
( )
A.醋酸溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(CH3COO-)
B.0.10mol/L的CH3COOH溶液加水稀释,溶液中c(OH-)减小
C.CH3COOH溶液中加入少量的CH3COONa固体,平衡逆向移动
D.常温下,pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合后,溶液的pH<7
[答案]B
[解析]根据电荷守恒,可得:c(H+)=c( )+C(
)+C(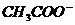 ),故A项对;0.1mol/lCH3COOH在加水稀释过程中酸性减弱,即c(H+)减小,而在一定温度下,C(H+)·C(
),故A项对;0.1mol/lCH3COOH在加水稀释过程中酸性减弱,即c(H+)减小,而在一定温度下,C(H+)·C( )=Kw是一定值,故c(
)=Kw是一定值,故c( )增大,所以B错;在醋酸中加入醋酸钠,c(
)增大,所以B错;在醋酸中加入醋酸钠,c(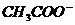 )增大,所以平衡向左移动,故C对;pH=2的CH3COOH中pH=12的NaOH中c(H+)=c(
)增大,所以平衡向左移动,故C对;pH=2的CH3COOH中pH=12的NaOH中c(H+)=c( ),但由于醋酸是弱酸,部分电离,故醋酸的物质的量浓度大于NaOH,二者等体积混合后,醋酸过量,所以溶液显酸性,即pH<7,所以D对21世纪教育网
),但由于醋酸是弱酸,部分电离,故醋酸的物质的量浓度大于NaOH,二者等体积混合后,醋酸过量,所以溶液显酸性,即pH<7,所以D对21世纪教育网
规律:
(1)弱酸在加入水稀释的过程中H+与弱酸根离子的浓度都在减小,只有对应的 浓度在增加(如果改成氨水讨论的方法相同)
浓度在增加(如果改成氨水讨论的方法相同)
(2)PH之和为14的酸与碱等体积混合后,若都是强的则呈中性,若有弱的溶液呈弱的一方的性质,(把选项D的溶液改为氨水与盐酸同样讨论,若使溶液呈中性则加入的弱的一方的体积应该少)
3. 质子守恒:电解质溶液中分子或离子得到或失去质子(H+)的物质的量应相等。例如在NH4HCO3溶液中H3O+、H2CO3为得到质子后的产物;NH3、 、
、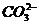 为失去质子后的产物,故有以下关系:C(H3O+)+C(H2CO3)=C(NH3)+C(
为失去质子后的产物,故有以下关系:C(H3O+)+C(H2CO3)=C(NH3)+C( )+C(
)+C(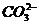 )。
)。
2. 物料守恒:电解质溶液中由于电离或水解因素,离子会发生变化变成其它离子或分子等,但离子或分子中某种特定元素的原子的总数是不会改变的。如NaHCO3溶液中nC(Na+):nC(C)=1:1,推出:C(Na+)=C(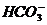 )+C(
)+C(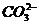 )+C(H2CO3)
)+C(H2CO3)
1. 电荷守恒:电解质溶液中所有阳离子所带有的正电荷数与所有的阴离子所带的负电荷数相等。如NaHCO3溶液中:nC(Na+)+nC(H+)=nC(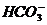 )+2nC(
)+2nC(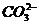 )+nC(
)+nC( )推出:C(Na+)+C(H+)=C(
)推出:C(Na+)+C(H+)=C(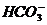 )+2C(
)+2C(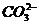 )+C(
)+C( )
)
3. 用物质的量都是0.1
mol的CH3COOH和CH3COONa配制成1L混合溶液,已知其中C(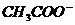 )>C(Na+),对该混合溶液的下列判断正确的是( )
)>C(Na+),对该混合溶液的下列判断正确的是( )
A.C(H+)>C( )
B.C(CH3COOH)+C(
)
B.C(CH3COOH)+C(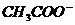 )=0.2 mol/L
)=0.2 mol/L
C.C(CH3COOH)>C(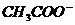 ) D.C(CH3COO-)+C(
) D.C(CH3COO-)+C( )=0.2 mol/L
)=0.2 mol/L
答案:B
方法要领: CH3COOH和CH3COONa的混合溶液中,CH3COOH的电离和CH3COONa的水解因素同时存在。已知C(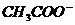 )>C(Na+),根据电荷守恒C(
)>C(Na+),根据电荷守恒C(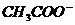 )+C(
)+C( )=C(Na+)+C(H+),可得出C(
)=C(Na+)+C(H+),可得出C( )<C(H+)。说明混合溶液呈酸性,进一步推测出0.1mol/L的CH3COOH和0.1mol/L的CH3COONa溶液中,电离和水解这一对矛盾中起主要作用是电离,即CH3COOH的电离趋势大于
)<C(H+)。说明混合溶液呈酸性,进一步推测出0.1mol/L的CH3COOH和0.1mol/L的CH3COONa溶液中,电离和水解这一对矛盾中起主要作用是电离,即CH3COOH的电离趋势大于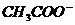 的水解趋势。根据物料守恒,可推出(B)是正确的21世纪教育网
的水解趋势。根据物料守恒,可推出(B)是正确的21世纪教育网
[规律总结]
2. 在0.1 mol/l的NH3·H2O溶液中,下列关系正确的是
A.C(NH3·H2O)>C( )>C(
)>C(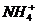 )>C(H+)
)>C(H+)
B.C(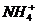 )>C(NH3·H2O)>C(
)>C(NH3·H2O)>C( )>C(H+)
)>C(H+)
C.C(NH3·H2O)>C(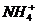 )=C(
)=C( )>C(H+)
)>C(H+)
D.C(NH3·H2O)>C(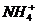 )>C(H+)>C(
)>C(H+)>C( )
)
[答案]A。
[方法要领]NH3·H2O是一元弱酸,属于弱电解质,在水溶液中少部分发生电离(NH3·H2O 
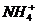 +
+ ),所以C(NH3·H2O)必大于C(NH4+)及C(
),所以C(NH3·H2O)必大于C(NH4+)及C( )。因为C(
)。因为C( )=C(H+)+C(
)=C(H+)+C(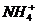 ),所以C(
),所以C( )>C(
)>C(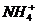 )。综合起来,C(NH3·H2O)>C(
)。综合起来,C(NH3·H2O)>C( )>C(
)>C(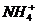 )>C(H+)21世纪教育网
)>C(H+)21世纪教育网
1. 能促进水的电离,并使溶液中C(H+)>C( )的操作是 ( )
)的操作是 ( )
(1)将水加热煮沸 (2)向水中投入一小块金属钠 (3)向水中通CO2 (4)向水中通
NH3 (5)向水中加入明矾晶体 (6)向水中加入NaHCO3固体 (7)向水中加NaHSO4固体
A.(1)(3)(6)(7) B.(1)(3)(6) C.(5)(7) D.(5)
[答案] D
[方法要领]本题主要考查外界条件对水的电离平衡的影响,请按如下思路完成本题的解:本题涉及到哪些条件对水的电离平衡的影响?各自对水的电离平衡如何影响?结果任何(C(H+)与C( )相对大小)?归纳酸、碱、盐对水的电离平衡的影响。
)相对大小)?归纳酸、碱、盐对水的电离平衡的影响。
31.(2010·徐州十月摸底考试)下列各句中加点的成语使用正确的一项是 ( )
A.老尹的柜子里摆满了他多年收藏的各种款式的打火机,每次他向别人介绍这些宝贝的时候,总是如数家珍。
B.冬天,老年人要增加营养,也要适当运动,在户外锻炼时,一定要量入为出,以步行为宜,时间最好选在傍晚,还要注意保暖,防止着凉。
C.小王看好了那件款式新颖的运动鞋,可惜带的钱不够,只好忍痛割爱了。
D.六年未出片的林志颖最近发行新专辑《挡不住我》,为了这张专辑,他推掉了多部戏约,但他一点也不以为意,总觉得一定要做自己喜欢的事才会开心。
[解析] A如数家珍:好像数着自家的珍宝那样清楚。比喻对所讲的事情十分熟悉。各种款式的打火机本身就是“家珍”,谈不上“如”;B量入为出:根据收入的多少来定开支的限度。C忍痛割爱:忍痛把自己心爱的东西交给别人。
[答案] D
30.(2010·全国第二次联考)下列各句中,加点的成语使用正确的一句是 ( )
A.法院对“517”交通肇事案进行了一审公开宣判,以交通肇事罪判处被告人胡某有期徒刑三年。判决结果一公布,许多网友认为处罚过重,罚不当罪。
B.广交会为企业提供了内外贸易对接的契机,但这种对接不可能一挥而就,绝大多数出口企业由于不熟悉国内市场,即使有意内销也无从着手。
C.在甲型H1N1流感暴发初期,医学专家最感到左右为难的是,如何判断和预测疫情的规模和发展趋势,以便为公共决策提供更多的科学依据。
D.卡夫卡写小说常采用寓言体,寓意人言人殊,永无定论。像《变形记》这样在内容与表达方面不可理喻的作品,一般的读者往往对其敬而远之。
[解析] B.一挥而就:指绘画、书法和写文章一动笔很快就完成了,形容才思敏捷,才智聪颖。C.左右为难:左也难,右也难,两边为难。形容处于某种困难中,不易做出决定。“如何判断和预测疫情的规模和发展趋势”不属于处于某处困境中,不易做出决定。D.不可理喻:形容人不讲道理。
[答案] A
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com