
8.浓度都是1 mol·L-1的四种正盐溶液:AX、BX、AY、BY;AX的溶液pH=7且溶液中 c(x-)=1 mol·L-1,BX的溶液pH=4,BY的溶液pH=6。则AY的溶液pH为 ( )
A.大于7 B.等于7 C.小于7 D.无法判断
7.室温下,有关下列四种溶液的叙述正确的是(忽略溶液混合的体积变化)
|
|
① |
② |
③ |
④ |
|
pH |
12 |
12 |
2 |
2 |
|
溶液 |
氨水 |
氢氧化钠溶液 |
醋酸 |
盐酸 |
A.在①、②中分别加入氯化铵晶体,两溶液的pH值均增大
B.分别将等体积的①和②加水稀释100倍,所得溶液的pH:①>②
C.把①、④两溶液等体积混合后所得溶液中:c(Cl-)>c(NH4+)>c(OH-)>c(H+)
D.将溶液②和溶液③等体积混合,混合后所得溶液pH=7
6.(08-09学年第一学期余姚期末模拟卷)氯气溶于水达到饱和后,若其他条件不变,只改变某一条件,下列叙述正确的是
A.再通入少量氯气,c(H+)/c(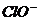 )减小
)减小
B.通入少量HCl,溶液漂白性增强
C.加入少量固体NaOH,一定有c(Na+)=c(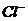 )+c(
)+c(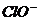 )
)
D.加入少量水,水的电离平衡向正反应方向移动
5. 在氯化铵溶液中,下列关系式正确的是
A.C(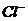 )>C(
)>C(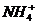 )>C(H+)>C(
)>C(H+)>C( )
)
B.C(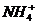 )>C(
)>C(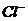 )>C(H+)>C(
)>C(H+)>C( )
)
C.C(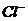 )=C(
)=C(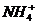 )>C(H+)=C(
)>C(H+)=C( )
)
D.C(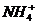 )=C(
)=C(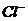 )>C(H+)>C(
)>C(H+)>C( )
)
4. 某溶液中由水电离出来的C( )=10-12mol/L,则该溶液中的溶质不可能是( )
)=10-12mol/L,则该溶液中的溶质不可能是( )
A.HCl B.NaOH C.NH4Cl D.H2SO4
3. 某温度时,水的离子积为1.0×10-12,由此可知在该温度时纯水电离的c(H+)为
A. 1.0×10-7 B. 1.0×10-2 C. 1.0×10-6 D. 1.0×10-14
2. 在甲烧杯中放入盐酸,乙烧杯中放入醋酸,两种溶液的体积和pH值都相等,向两烧杯中同时加入质量不等的锌粒,反应结束后得等量的氢气。下列说法正确的是:
A.甲烧杯中放入锌的质量比乙烧杯中放入锌的质量大;
B.甲烧杯中的酸过量;
C.两烧杯中参加反应的锌等量;
D.反应开始后乙烧杯中的c(H+)始终比甲烧杯中的c(H+)小。
1.

 (09年全国2) 现有等浓度的下列溶液:①醋酸,②苯酚,③苯酚钠,④碳酸,⑤碳酸钠,⑥碳酸氢钠。按溶液pH由小到大排列正确的是
(09年全国2) 现有等浓度的下列溶液:①醋酸,②苯酚,③苯酚钠,④碳酸,⑤碳酸钠,⑥碳酸氢钠。按溶液pH由小到大排列正确的是

 A.
④①②⑤⑥③
B. ④①②⑥⑤③
A.
④①②⑤⑥③
B. ④①②⑥⑤③

 C.
①④②⑥③⑤
D. ①④②③⑥⑤
C.
①④②⑥③⑤
D. ①④②③⑥⑤
7. 25ºC,若10体积的某强碱溶液与1体积的某强酸溶液混合后,溶液呈中性,则混合之前,
该碱的pH与强酸的pH之间该满足的关系是_______________________
[答案]a+b=13
[解析]由题意知,本题为酸、碱混合后完全中和,根据中和反应的实质可知,酸中n(H+)与碱中n(OH-)相等,故有C(H+)酸V酸 == C(OH-)碱V碱,由此关系列式可求得结果。
[解答]设酸的pH为a,C(H+)酸=10-a,碱的pH为b,C(OH-)碱=10-14 /
10-b=10- (14 - b) 因为混合后溶液呈中性,所以C(H+)酸V酸 == C( )碱V碱
)碱V碱
10-a ×V = 10 - (14 - b) ×10V = 10 - (13 - b) ×V
10-a = 10 - (13 - b)
两边取负对数:-lg10-a = -lg10 - (13 - b),a=13-b a+b=13
即酸的pH与碱的pH之和为13
[典例精析]
例1. 某温度下纯水中C(H+) = 2×10-7 mol/L,则此时溶液中的C( ) = ___________。
) = ___________。
若温度不变,滴入稀盐酸使C(H+)
= 5×10-6 mol/L,则此时溶液中的C( ) = ___________。
) = ___________。
[解析]由水电离产生的H+与OH-量始终相等,知纯水中C(H+)
= C( )。根据纯水中
)。根据纯水中
C(H+) 与C( )可求出此温度下水的Kw的值,由Kw的性质(只与温度有关,与离子浓度无关),若温度不变,稀盐酸中Kw仍为此值,利用此值可求出盐酸中的C(
)可求出此温度下水的Kw的值,由Kw的性质(只与温度有关,与离子浓度无关),若温度不变,稀盐酸中Kw仍为此值,利用此值可求出盐酸中的C( )。
)。
[答案]纯水中 C( ) = C(H+)
= 2×10-7 mol/L
) = C(H+)
= 2×10-7 mol/L
Kw = C(H+)·C( ) = 2×10-7×2×10-7
= 4×10-14
) = 2×10-7×2×10-7
= 4×10-14
稀盐酸中 C( ) = Kw / C(H+)
= (4×10-14) / (5×10-6) = 8×10-9 mol/L
) = Kw / C(H+)
= (4×10-14) / (5×10-6) = 8×10-9 mol/L
例2. 把0.02mol/LCH3COOH溶液和0.01mol/LNaOH溶液等体积混合,则混合溶液中微粒浓度关系正确的是( )
A.C(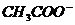 )>C(Na+)
)>C(Na+)
B.C(CH3COOH)>C(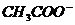 )
)
C.2C(H+)=C(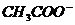 )-C(CH3COOH)
)-C(CH3COOH)
D.C(CH3COOH)+
C(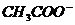 )=0.01mol/L
)=0.01mol/L
[解析]此题实质上是0.05mol/L的CH3COOH溶液和0.05mol/L的CH3COONa溶液的混合溶液。由电荷守恒关系可得: c(H+)+c(Na+)=c(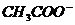 )+c(OH-) (1)
)+c(OH-) (1)
由物料守恒关系可得: c(CH3COOH)+c(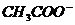 )=c(Na+)×2=0.01mol/L (2)
)=c(Na+)×2=0.01mol/L (2)
由(2)可知D正确。将(1)×2+(2)可得:2c(H+)=c(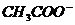 )+2c(OH-)-c(CH3COOH)(3)C选项错误21世纪教育网
)+2c(OH-)-c(CH3COOH)(3)C选项错误21世纪教育网
[答案]D
例3. 下列叙述正确的是
A.0.1mol·L-1氨水中,c( )==c(NH4+)
)==c(NH4+)
B.10 mL 0.02mol·L-1HCl溶液与10 mL 0.02mol·L-1Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=12
C.在0.1mol·L-1CH3COONa溶液中,c( )==c(CH3COOH)+c(H+)
)==c(CH3COOH)+c(H+)
D.0.1mol·L-1某二元弱酸强碱盐NaHA溶液中,c(Na+)==2c(A2-)+c(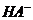 )+c(H2A)
)+c(H2A)
[解析]NH3·H2O是弱电解质,它本身电离所产生的两种离子浓度相等,得氨水中的部分 来自于H2O的电离,所以c(OH-)>c(NH4+),A错;B项中酸碱中和反应后,
来自于H2O的电离,所以c(OH-)>c(NH4+),A错;B项中酸碱中和反应后,
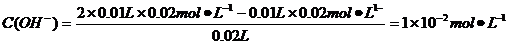
pH=-lgC(H+)=-lg(10-14/10-12)=12,B正确;根据盐的消解规律,可以判断C正确;D项中因钠元素的离子与A原子的物质的量之比为1∶1,对应关系应该为c(Na+)=c(A2-)+c(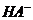 )+c(H2A),D错。
)+c(H2A),D错。
[答案]BC
 例4.(09年天津)下列叙述正确的是
例4.(09年天津)下列叙述正确的是
 A. 0.1 mol/LC6H5ONa溶液中:c(Na+)>c(C6H5O-)>c(H+)>c(OH-)
A. 0.1 mol/LC6H5ONa溶液中:c(Na+)>c(C6H5O-)>c(H+)>c(OH-)
 B. Na2CO3溶液加水稀释后,恢复至原温度,pH和Kw均减小
B. Na2CO3溶液加水稀释后,恢复至原温度,pH和Kw均减小
 C. pH=5的CH3COOH溶液和Ph=5的NH4Cl溶液中,c(H+)不相等
C. pH=5的CH3COOH溶液和Ph=5的NH4Cl溶液中,c(H+)不相等
 D. 在Na2S溶液中加入AgCl固体,溶液中c(S2-)下降
D. 在Na2S溶液中加入AgCl固体,溶液中c(S2-)下降
[解析]A项,苯酚钠为碱性溶液,故错;B项,温度不变,则Kw是不变的,错;C项,pH=5即代表溶液中C(H+)均为10-5mol/L,错。D项,Ag2S比AgCl更难溶,故加入S2-会与溶液中的Ag+结合的,正确21世纪教育网
[答案]D
例5.(09年全国1) 用0.1
mol•. 的盐酸滴定0.10 mol•.
的盐酸滴定0.10 mol•. 的氨水,滴定过程中不可能出现的结果是
的氨水,滴定过程中不可能出现的结果是
A.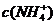 >
>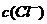 ,
,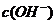 >
>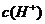 B.
B. 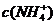 =
=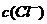 ,
,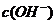 =
=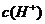
C.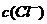 >
>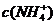 ,
,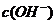 >
>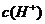 D.
D. 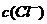 >
>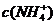 ,
,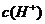 >
>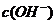
[解析]溶液中不可能出现阴离子均大于阳离子的情况,不遵循电荷守恒,故C项错。
[答案]C
 例6.(09年福建)在一定条件下,Na2CO3溶液存在水解平衡:
例6.(09年福建)在一定条件下,Na2CO3溶液存在水解平衡:
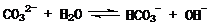 。下列说法正确的是
。下列说法正确的是
 A. 稀释溶液,水解平衡常数增大
B. 通入CO2,平衡朝正反应方向移动
A. 稀释溶液,水解平衡常数增大
B. 通入CO2,平衡朝正反应方向移动
 C. 升高温度,
C. 升高温度,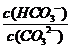 减小
D. 加入NaOH固体,溶液PH减小
减小
D. 加入NaOH固体,溶液PH减小
[解析]平衡常数仅与温度有关,故稀释时是不变的,A项错;CO2通入水中,相当于生成H2CO3,可以与OH-反应,而促进平衡正向移动,B项正确;升温,促进水解,平衡正向移动,故表达式的结果是增大的,C项错;D项,加入NaOH,碱性肯定增强,pH增大,故错。
[答案]B
 例7.(09年安徽) 向体积为0.05mol·L-1CH3COOH溶液中加入体积为Vb的0.05mol·L-1KOH溶液,下列关系错误的是
例7.(09年安徽) 向体积为0.05mol·L-1CH3COOH溶液中加入体积为Vb的0.05mol·L-1KOH溶液,下列关系错误的是
 A. Va>Vb时:c (CH3COOH) +c (CH3COO-)>c
(K+)
A. Va>Vb时:c (CH3COOH) +c (CH3COO-)>c
(K+)
 B. Va=Vb时:c (CH3COOH) +c (H+)>c
(OH-)
B. Va=Vb时:c (CH3COOH) +c (H+)>c
(OH-)
 C. Va<Vb时:c (CH3COO-)>c (K+)> c (OH-)> c (H)
C. Va<Vb时:c (CH3COO-)>c (K+)> c (OH-)> c (H)
 D. Va与Vb任意比时:c (K+)+ c (H+)
=c (OH-)+ c (CH3COO-)
D. Va与Vb任意比时:c (K+)+ c (H+)
=c (OH-)+ c (CH3COO-)
 [解析]若Va>Vb,醋酸过量,根据物料守恒可知,n(CH3COOH)+ n(CH3COO-)=0.05Va,n(K+)= 0.05VVb,则A选项正确;若Va=Vb,反应后为CH3COOK溶液,由于的CH3COO-水解而显碱性,根据质子守恒可知,B选项正确;若Va<Vb,说明碱过量,当碱液加的量足够多,则可以存在c(K+)>c(CH3COO-),C选项错误;D选项符合电荷守恒,正确。
[解析]若Va>Vb,醋酸过量,根据物料守恒可知,n(CH3COOH)+ n(CH3COO-)=0.05Va,n(K+)= 0.05VVb,则A选项正确;若Va=Vb,反应后为CH3COOK溶液,由于的CH3COO-水解而显碱性,根据质子守恒可知,B选项正确;若Va<Vb,说明碱过量,当碱液加的量足够多,则可以存在c(K+)>c(CH3COO-),C选项错误;D选项符合电荷守恒,正确。
 [答案]C
[答案]C
 例8.(09年广东) 下列浓度关系正确的是
例8.(09年广东) 下列浓度关系正确的是
 A. 氯水中:c(Cl2)=2[c(
A. 氯水中:c(Cl2)=2[c(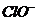 )+c(
)+c(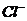 )+C(HClO)]
)+C(HClO)]
 B. 氯水中:c(
B. 氯水中:c(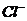 )>c(
)>c(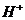 )>c(
)>c( )>c(
)>c(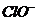 )
)
 C. 等体积等浓度的氢氧化钠与醋酸混合:c(
C. 等体积等浓度的氢氧化钠与醋酸混合:c(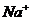 )=c(
)=c(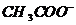 )
)
 D.
D. 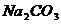 溶液中:c
溶液中:c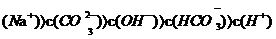
 [解析]根据氯水中所含粒子的种类可知氯水中也含有氯气分子A设置了一个貌似物料守恒的式子而忽视了氯气分子的存在,故A错;根据Cl2+H2O
[解析]根据氯水中所含粒子的种类可知氯水中也含有氯气分子A设置了一个貌似物料守恒的式子而忽视了氯气分子的存在,故A错;根据Cl2+H2O HClO+H++
HClO+H++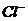 ,HCl完全电离 而HClO部分电离,可知正确的顺序c(H+)>c(
,HCl完全电离 而HClO部分电离,可知正确的顺序c(H+)>c(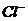 )>c(
)>c(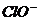 )>c(
)>c( ),B错;C项等物资的量的强碱与弱酸混合生成强碱弱酸盐溶液显碱性c(
),B错;C项等物资的量的强碱与弱酸混合生成强碱弱酸盐溶液显碱性c( )>c(
)>c(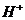 ),再根据溶液中电荷守恒可以判断c(
),再根据溶液中电荷守恒可以判断c(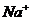 )>c(
)>c(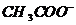 );D项比较简单
);D项比较简单
 [答案]D
[答案]D
例9.已知0.1 mol·L-1的二元酸H2A溶液的pH=4.0,则下列说法正确的是 ( )
A.在Na2A、NaHA两溶液中,离子种类不相同
B.在溶质物质的量相等的Na2A、NaHA两溶液中,阴离子总数相等
C.在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(OH-)+2c(A2-)
D.在Na2A溶液中一定有:c(Na+)>c(A2-)>c(H+)>c(OH-)
[解析]0.1 mol·L-1的强酸pH=1.0,0.1 mol·L-1的H2A溶液pH=4.0,说明它是一种弱酸。Na2A发生水解A2-+H2O HA-+OH-和HA-+H2O
HA-+OH-和HA-+H2O H2A+OH-,溶液中存在HA-、A2-、H+、OH-;NaHA发生水解HA-+H2O
H2A+OH-,溶液中存在HA-、A2-、H+、OH-;NaHA发生水解HA-+H2O H2A+OH-和电离HA-
H2A+OH-和电离HA- H++A2-,溶液中存在HA-、A2-、H+、OH-,所以两溶液中离子种类相同,A不正确。
H++A2-,溶液中存在HA-、A2-、H+、OH-,所以两溶液中离子种类相同,A不正确。
物质的量相等的Na2A和NaHA因为存在上述水解、电离等过程,阴离子数量发生变化,所以阴离子总量不相等,B不正确。
由电荷守恒可知c(Na+)+c(H+)=c(HA-)+c( )+2c(A2-),C正确。Na2A溶液显碱性,c(
)+2c(A2-),C正确。Na2A溶液显碱性,c( )>c(H+),D不正确21世纪教育网
)>c(H+),D不正确21世纪教育网
[答案]C
例11. 用水稀释0.1摩/升氨水时,溶液中随着水量的增加而减小的是( )
A.
c(OH-)/c(NH3·H2O)
B. c(NH3·H2O)/c( )
C.
c(H+)和c(
)
C.
c(H+)和c( )的乘积
D. OH-的物质的量
)的乘积
D. OH-的物质的量
[解析]加水稀释,一方面溶液中所有的微粒的浓度都会同等程度地降低;另一方面氨水的电离平衡将向电离的方向移动,即产物降低的幅度小一点,反应物降低的幅度大一点;随着电离平衡向电离的方向移动, 的数目或物质的量还是比稀释前要多。
的数目或物质的量还是比稀释前要多。
[答案] B
例12. Fe(OH)3难溶于水,存在平衡:Fe(OH)3 Fe3++3
Fe3++3 ,在Fe(OH)3悬浊物中加入少量下列物质后,可使溶液中的Fe3+浓度增大的是
,在Fe(OH)3悬浊物中加入少量下列物质后,可使溶液中的Fe3+浓度增大的是
A.NaOH溶液 B.稀HCl C.稀HI D.水
[解析:]A项增大了 浓度,使平衡向逆反应方向移动;B项消耗
浓度,使平衡向逆反应方向移动;B项消耗 ,使平衡向正向移动;C项既消耗
,使平衡向正向移动;C项既消耗 ,
,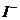 又能与Fe3+发生氧化还原反应;D项的平衡尽管向正向移动,但溶液中所有的微粒浓度都会降低。
又能与Fe3+发生氧化还原反应;D项的平衡尽管向正向移动,但溶液中所有的微粒浓度都会降低。
[答案] B。
例13.下列说法正确的是
A. 相同温度下,1 mol·L-1氨水溶液与0.5 mol·L-1氨水溶液中,c(OH-)之比是2:1
B. 0.1 mol·L-1 NH4Cl溶液中的c(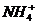 )=c(
)=c(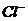 )
)
C. 向0.1 mol·L-1NaNO3 溶液中滴加稀盐酸,使溶液pH=1,此时混合液中c(Na+)=c(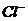 )
)
D. 向醋酸钠溶液中加入适量醋酸,使 混合液的pH=7,此时混合液中c(Na+)=c(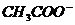 )
)
[解析]A项中如果是强碱,其浓度之比与 浓度之比相等,但此处氨水是弱碱,稀氨水的电离程度大,所以二者的
浓度之比相等,但此处氨水是弱碱,稀氨水的电离程度大,所以二者的 浓度之比小于2:1;B项中如果是强酸强碱盐,不发生水解,则等式成立,但NH4Cl中的
浓度之比小于2:1;B项中如果是强酸强碱盐,不发生水解,则等式成立,但NH4Cl中的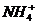 水解后,消耗OH-、积累H+,c(
水解后,消耗OH-、积累H+,c(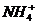 )<c(
)<c(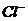 )。C项中NaNO3和HCl都是强电解质,完全电离为离子,满足己知条件要求。D项中pH=7,c(H+)=C(
)。C项中NaNO3和HCl都是强电解质,完全电离为离子,满足己知条件要求。D项中pH=7,c(H+)=C(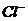 ),根据电荷守恒:C(H+)+C(Na+)=C(
),根据电荷守恒:C(H+)+C(Na+)=C( )+C(
)+C(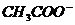 ),即得答案。
),即得答案。
[答案]CD21世纪教育网
例14. 取pH值均等于2的盐酸和醋酸各100ml分别稀释2倍后,再分别加入0.03g锌粉,在相同条件下充分反应,有关叙述正确的是
A.醋酸与锌反应放出氢气多
B.盐酸和醋酸分别与锌反应放出的氢气一样多
C.醋酸与锌反应速率大
D.盐酸和醋分别与锌反应的速度一样大
[解析] 影响生成氢气多少的是酸最多提供的n(H+)的多少,而与其浓度大小无关;影响生成氢气速率大小的是酸己电离的c(H+)大小,而与其物质的量多少无关。
n(HCl)=0.01×0.1=0.001mol ,n (Zn)=0.03/65=0.00046 mol , n(CH3COOH)> 0.01mol。由反应关系来看,两酸均过量,则产生同样多的氢气。
PH=2的两酸稀释相同倍数后,由于醋酸的继续电离,使得c(H+,CH3COOH)>c(H+,HCl),故醋酸产生氢气和速率大。
[答案]BC21世纪教育网
例15. 在下列叙述中,能说明盐酸是强酸,醋酸是弱酸的是
A.将pH=4的盐酸和醋酸稀释成pH=5的溶液,醋酸所需加入的水量多
B.盐酸和醋酸都可用相应的钠盐与浓硫酸反应制取
C.相同pH值的盐酸和醋酸溶液中分别加入相应的钠盐固体,醋酸的pH值变化大
D.相同pH值的盐酸和醋酸分别跟锌反应时,产生氢气的起始速度相等
[解析]A项中醋酸在稀释过程中电离程度加大,要想达到与盐酸一样的H+浓度,所需加水要多;B项中的醋酸不能用浓硫酸来制取;C项中HCl加NaCl不会使其电离有什么变化,因为它本来己经完全电离了,而醋酸中加醋酸钠,将会抑制醋酸的电离;D项中pH相同,c(H+)肯定相等,只能说明起始c(H+)相等,不能说明反应中有何变化。
[答案]AC。
例16. 难溶化合物的饱和溶液存在着溶解平衡,例如:
AgCl(s) 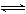 Ag++
Ag++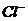 ,Ag2CrO4(s)
,Ag2CrO4(s)
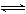 2Ag++
2Ag++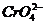 ,在一定温度下,难溶化合物饱和溶液离子浓度的乘积为一常数,这个常数用Ksp表示。
已知:Ksp(AgCl)=[Ag+][
,在一定温度下,难溶化合物饱和溶液离子浓度的乘积为一常数,这个常数用Ksp表示。
已知:Ksp(AgCl)=[Ag+][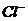 ]=1.8×10-10
Ksp(Ag2CrO4)=[Ag+]2[
]=1.8×10-10
Ksp(Ag2CrO4)=[Ag+]2[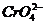 ]=1.9×10-12
现有0.001摩/升AgNO3溶液滴定0.001摩/升KCl和0.001摩/升的K2CrO4的混和溶液,试通过计算回答:
(1)
]=1.9×10-12
现有0.001摩/升AgNO3溶液滴定0.001摩/升KCl和0.001摩/升的K2CrO4的混和溶液,试通过计算回答:
(1) 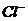 和
和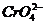 中哪种先沉淀?
中哪种先沉淀?
(2)当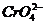 -以Ag2CrO4形式沉淀时,溶液中的
-以Ag2CrO4形式沉淀时,溶液中的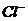 Cl-离子浓度是多少?
Cl-离子浓度是多少? 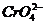 与
与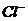 能否达到有效的分离?(设当一种离子开始沉淀时,另一种离子浓度小于10-5mol/L时,则认为可以达到有效分离)
能否达到有效的分离?(设当一种离子开始沉淀时,另一种离子浓度小于10-5mol/L时,则认为可以达到有效分离)
[解析](1)当溶液中某物质离子浓度的乘积大于Ksp时,会形成沉淀。几种离子共同沉淀某种离子时,根据各离子积计算出所需的离子浓度越小越容易沉淀。(2)由Ag2CrO4沉淀时所需Ag+浓度求出此时溶液中Cl-的浓度可判断是否达到有效分离。
[答案](1)AgCl饱和所需 Ag+浓度[Ag+]1=1.8×10-7摩/升
Ag2CrO4饱和所需Ag+浓度[Ag+]2==4.36×10-5摩/升
[Ag+]1<[Ag+]2,Cl-先沉淀。
(2) Ag2CrO4开始沉淀时[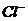 ]==4.13×10-6<10-5,所以能有效地分离。
]==4.13×10-6<10-5,所以能有效地分离。
 例17.(09年山东)运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
例17.(09年山东)运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
 (1)合成氨反应反应N2(g)+3H2(g)
(1)合成氨反应反应N2(g)+3H2(g)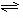 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡 移动(填“向左”“向右”或“不”);,使用催化剂 反应的ΔH(填“增大”“减小”或“不改变”)21世纪教育网
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡 移动(填“向左”“向右”或“不”);,使用催化剂 反应的ΔH(填“增大”“减小”或“不改变”)21世纪教育网
 (2)O2 (g)= O+2(g)+e-
(2)O2 (g)= O+2(g)+e-  H1= 1175.7 kJ·mol-1
H1= 1175.7 kJ·mol-1
 PtF6(g)+ e-1
PtF6(g)+ e-1 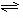 PtF6-(g)
PtF6-(g)  H2= - 771.1 kJ·mol-1
H2= - 771.1 kJ·mol-1
 O2+PtF6-(s)=O2+(g)+PtF6-
O2+PtF6-(s)=O2+(g)+PtF6-
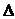 H3=482.2 kJ·mol-1
H3=482.2 kJ·mol-1
 则反应O2(g)+ PtF6 (g) = O2+PtF6-
(s)的
则反应O2(g)+ PtF6 (g) = O2+PtF6-
(s)的 H=_____________ kJ·mol-1。
H=_____________ kJ·mol-1。
 (3)在25℃下,向浓度均为0.1 mol·L-1的MgCL2和CuCl2混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式为____________。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.2×10-20。
(3)在25℃下,向浓度均为0.1 mol·L-1的MgCL2和CuCl2混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式为____________。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.2×10-20。
 (4)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4*)=c(
(4)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4*)=c(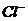 ),则溶液显_____________性(填“酸”“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb=__________21世纪教育网
),则溶液显_____________性(填“酸”“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb=__________21世纪教育网
 [解析](1)在恒压条件下加入氩气,则容积增大,导致原平衡中各物质的浓度同等比例减小,所以平衡向气体体积增大的方向即向左移动;催化剂仅是改变化学反应速率,不会影响焓变。(2)根据盖斯定律,将化学方程式①+②-③叠加。(3)Cu(OH)2 的Ksp小于Mg(OH)2的,所以离子的浓度商首先大于Cu(OH)2
的而先沉淀;由于氨水是弱碱,书写离子方程式时不能拆开。(4)由溶液的电荷守恒可得: c(H*)+c(
[解析](1)在恒压条件下加入氩气,则容积增大,导致原平衡中各物质的浓度同等比例减小,所以平衡向气体体积增大的方向即向左移动;催化剂仅是改变化学反应速率,不会影响焓变。(2)根据盖斯定律,将化学方程式①+②-③叠加。(3)Cu(OH)2 的Ksp小于Mg(OH)2的,所以离子的浓度商首先大于Cu(OH)2
的而先沉淀;由于氨水是弱碱,书写离子方程式时不能拆开。(4)由溶液的电荷守恒可得: c(H*)+c(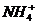 )=c(
)=c(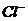 )+c(
)+c( ),已知c(
),已知c(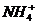 )=c(
)=c(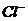 ),则有c(H*)=c(OH-),溶液显中性;电离常数只与温度有关,则此时NH3·H2O的电离常数Kb=
[c(
),则有c(H*)=c(OH-),溶液显中性;电离常数只与温度有关,则此时NH3·H2O的电离常数Kb=
[c(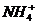 )·c(OH-)]/c(NH3·H2O)=
(0.01 mol·L-1·10-7mol·L-1)/(amol·L-1-0.01
mol·L-1)= 10-9/( (a-0.01)mol·L-1.
)·c(OH-)]/c(NH3·H2O)=
(0.01 mol·L-1·10-7mol·L-1)/(amol·L-1-0.01
mol·L-1)= 10-9/( (a-0.01)mol·L-1.
 [答案](1)向左 不改变 (2)-77.6 (3)Cu(OH)2 Cu2++2NH3·H2O=Cu(OH)2
↓+2
[答案](1)向左 不改变 (2)-77.6 (3)Cu(OH)2 Cu2++2NH3·H2O=Cu(OH)2
↓+2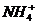
 (4)中 Kb=10-9/(
(a-0.01)mol·L-1.
(4)中 Kb=10-9/(
(a-0.01)mol·L-1.
[专题突破]
6. 以下是25℃时几种难溶电解质的溶解度:
|
难溶电解质 |
Mg(OH)2 |
Cu(OH)2 |
Fe(OH)2 |
Fe(OH)3 |
|
溶解度/g |
9×10-4 |
1.7×10-6 |
1.5×10-4 |
3.0×10-9 |
在无机化合物的提纯中,常利用难溶电解质的溶解平衡原理除去某些离子。例如:
①为了除去氯化铵中的杂质Fe3+,先将混合物溶于水,加入一定量的试剂反应,过滤结晶
② 为了除去氯化镁晶体中的杂质Fe3+,先将混合物溶于水,加入足量的氢氧化镁,充分反应,过滤结晶
③ 为了除去硫酸铜晶体中的杂质Fe2+,先将混合物溶于水,加入一定量的H2O2,将Fe2+氧化成Fe3+,调节溶液的pH=4,过滤结晶
请回答下列问题:
(1)上述三个除杂方案都能够达到很好效果,Fe2+、Fe3+都被转化为 而除去
(2)①中加入的试剂应该选择_________为宜,其原因是________________________。
(3)②中除去Fe3+所发生的总反应的离子方程式为_____________________________。
(4)下列与方案③相关的叙述中,正确的是__________________(填字母)。
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质、不产生污染
B.将Fe2+氧化为Fe3+的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀较难过滤
C.调节溶液pH=4可选择的试剂是氢氧化铜或碱式碳酸铜
D.Cu2+可以大量存在于pH=4的溶液中
E.在pH>4的溶液中Fe3+一定不能大量存在
[答案](1)氢氧化铁(2)氨水;不会引入新的杂质(3)2Fe3++3Mg(OH)2 == 3 Mg2+ +2Fe(OH)3 (4)A C D E
[解析]由于氢氧化铁相对于氢氧化亚铁溶解度小,沉淀所需要的PH值低,所以通常将Fe2+氧化为Fe3+然后再进行沉淀,沉淀中存在溶解平衡,所以当加入溶解度更小的沉淀剂时,沉淀会发生转化,因些加入氢氧化镁时会发生氢氧化镁溶解生成氢氧化铁沉淀,加入沉淀剂时一般不能引入新的杂质,所以加入时应该加入与溶液中主要离子相同的阴离子或阳离子,所以为了除去硫酸铜晶体中的杂质Fe2+,先将混合物溶于水,加入一定量的H2O2,将Fe2+氧化成Fe3+,然后可以加入含有氧化铜,氢氧化铜等物质21世纪教育网
规律:
(1)利用沉淀平衡实现沉淀而除杂时,常加入与溶液中主要离子相同阳离子的难溶物进行处理,如除去氯化镁中的铁离子,可以加入氧化镁、氢氧化镁、碳酸镁、碳酸氢镁等
(2)除杂时不能引入新的杂质离子,如:将Fe2+氧化为Fe3+时,只能用H2O2、O3等,若溶液中原有氯离子,还可以考虑用氯水等,但不能加入溶液中不含有的离子。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com