
2、岩浆晶出顺序与晶格能的关系?
[投影] 岩浆:

[小结]晶格能越大,越早析出晶体。越早达到饱和,越易析出。
2、你认为什么因素决定了离子晶体中离子的配位数?利用相关数据计算,并填表:
|
ZnS |
NaCl |
CsCl |
|
r+/r-=0.2-0.4 |
r+/r-=0.52 |
r+/r-=0.93 |
|
C.N=4 |
C.N=6 |
C.N=8 |
[投影]探究练习参考资料:
|
离子 |
Na+ |
Cs+ |
Cl- |
|
离子半径/pm |
95 |
169 |
18l |
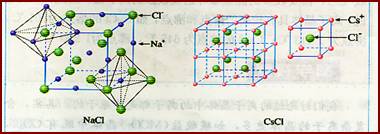
[讲] 显而易见,NaCl和CsCl是两种不同类型的晶体结构。晶体中正负离子的半径比(r+/r-)是决定离子晶体结构的重要因素,简称几何因素。
[板书]4、配位数:与中心离子(或原子)直接成键的离子(或原子)称为配位离子(原子)。
[讲]配位离子的数目称为配位数。
[板书]5、结构模型:
(1) 氯化钠晶体
[投影]
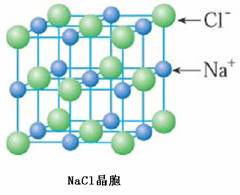

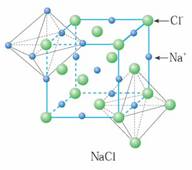

[讲]由下图氯化钠晶体结构模型可得:每个Na+紧邻6个Cl-,每个Cl-紧邻6个Na+(上、下、左、右、前、后),这6个离子构成一个正八面体。设紧邻的Na+与Cl-间的距离为a,每个Na+与12个Na+等距离紧邻(同层4个、上层4个、下层4个)。由均摊法可得:该晶胞中所拥有的Na+数为4个 , Cl-数为4个,晶体中Na+数与Cl-数之比为1:1,则此晶胞中含有4个NaCl结构单元。
[板书](2)氯化铯晶体
[讲]每个Cs+紧邻8个Cl-,每个Cl-紧邻8个Cs+,这8个离子构成一个正立方体。设紧邻的Cs+与Cs+间的距离为a,则每个Cs+与6个Cs+等距离紧邻(上、下、左、右、前、后)。晶体中的Cs+与Cl-数之比为1:1。
[投影]
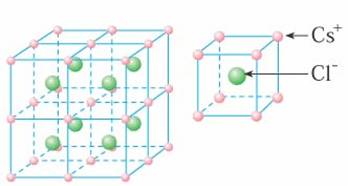

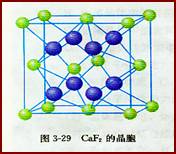
[讲] 上面两例中每种晶体的正负离子的配位数相同,是由于正负离子电荷(绝对值)相同,于是正负离子的个数相同,结果导致正负离子配位数相等,如在NaCl中,Na+扩和C1-的配位数均为6。如果正负离子的电荷不同,正负离子的个数必定不相同,结果,正负离子的配位数就不会相同。这种正负离子的电荷比也是决定离子晶体结构的重要因素,简称电荷因素。例如,在CaF2晶体中,Ca2+和F-的电荷比(绝对值)是2:l,Ca2+和F-的个数比是l:2,如图3-29所示。Ca2+的配位数为8,F-的配位数为4。此外,离子晶体的结构类型还取决于离子键的纯粹程度(简称键性因素)。
[投影]
[板书]6、影响因素:
(1) 几何因素:晶体中正负离子的半径比(r+/r-)。
[讲]离子键无饱和性和方向性,但成键时因离子半径决定了阴阳离子参加成键的数目是有限的。阴阳离子半径比值越大,配位数就越大。
[板书](2) 电荷因素:正负离子的电荷比。
(3) 键性因素:离子键的纯粹程度。
[讲] 在离子晶体中,离子间存在着较强的离子键,要克服离子间的相互作用使物质熔化和沸腾,就需要较多的能量。因此,离子晶体具有较高的熔点、沸点和难挥发的性质。
[板书]7、离子晶体特点:
(1) 较高的熔点和沸点,难挥发、难于压缩。
[讲]离子晶体的熔沸点,取决于构成晶体的阴阳离子间的离子键的强弱,而离子键的强弱,又可用离子半径衡量,通常情况下,同种类型的离子晶体,离子半径越小,离子键越强,熔沸点越高。
[讲]离子晶体中,由于离子键的强烈作用,离子晶体表现出较高的硬度,当晶体受到冲击力作用时,部分离子键发生断裂,导致晶体破碎。
[板书] (2) 硬而脆,无延展性
[讲]离子晶体中阴阳离子交替出现,层与层之间如果滑动,同性离子相邻而使斥力增大导致不稳定,所以离子晶体无延展性。
[讲]由于离子晶体中离子键作用较强,离子晶体不能自由移动,即晶体中无自由移动离子,因此,离子晶体不导电。当升高温度时,阴阳离子获得足够能量克服了离子间相互作用,成为自由移动的离子,在外界电场作用下,离子定向移动而导电。离子化合物溶于水时,阴阳离子受到水分子作用变成了自由移动的离子(或水合离子),在外界电场作用下,阴阳离子定向移动而导电。
[板书] (3) 不导电,但熔化后或溶于水后能导电。
[讲]当把离子晶体放在水中时,极性水分子对离子晶体中的离子产生吸引,使晶体中的离子克服离子间的作用而离开晶体,变成在水中自由移动的离子。
[板书](4) 大多数离子晶体易溶于极性溶剂中,难溶于非极性溶剂中。
[小结]化学变化过程一定发生旧化学键的断裂和新化学键的形成,但破坏化学键或形成化学键的过程却不一定发生化学变化。
[自学]科学视野-复杂离子的晶体
碳酸盐在一定温度下会发生分解,如大家熟悉的碳酸钙煅烧得到石灰(CaO),这是由于碳酸钙受热,晶体中的碳酸根离子会发生分解,放出二氧化碳。实验证明,碳酸盐的阳离子不同,热分解的温度不同。
|
碳酸盐 |
MgCO3 |
CaCO3 |
SrCO3 |
BaCO3 |
|
热分解温度/℃ |
402 |
900 |
1 172 |
1 360 |
|
阳离子半径/pm |
66 |
99 |
112 |
135 |

教 案
|
课题:第四节 离子晶体(2) |
授课班级 |
|
|||||||||
|
课 时 |
|
||||||||||
|
教 学 目 的 |
知识 与 技能 |
理解离子晶体的晶格能与性质的关系。 |
|||||||||
|
过程 与 方法 |
|
||||||||||
|
情感 态度 价值观 |
|
||||||||||
|
重 点 |
离子晶体的晶格能与性质的关系。 |
||||||||||
|
难 点 |
离子晶体的晶格能与性质的关系。 |
||||||||||
|
知 识 结 构 与 板 书 设 计 |
二、晶格能 1、定义:晶格能是指1mol的离子化合物中的阴阳离子,由相互远离的气态,结合成离子晶体时所释放出的能量或拆开1mol离子晶体使之形成气态阴离子和阳离子所吸收的能量。单位是kJ/mol 2、影响因素:离子的电荷和阴阳离子的大小。 3、规律:晶格能越大,形成的离子晶体越稳定,而且熔点越高,硬度越大。 |
||||||||||
|
教学过程 |
|||||||||||
|
教学步骤、内容 |
教学方法、手段、师生活动 |
||||||||||
|
[讲] 最能反映离子晶体稳定性的数据是它们的晶格能。离子晶体的品格能的定义是气态离子形成l摩离子晶体释放的能量,通常取正值,表3-8给出了某些离子晶体的晶格能数据。 [板书]二、晶格能 1、定义:晶格能是指1mol的离子化合物中的阴阳离子,由相互远离的气态,结合成离子晶体时所释放出的能量或拆开1mol离子晶体使之形成气态阴离子和阳离子所吸收的能量。单位是kJ/mol [投影]
[板书] 2、影响因素:离子的电荷和阴阳离子的大小。 [讲]晶格能与离子电荷的乘积成正比,与阴阳离子的大小成反比。 [观察] 分析晶格能大小与晶体稳定性关系。 [讲]晶格能的数据可以用来说明许多典型的离子晶体的物理化学性质的变化规律。 [板书]3、规律:晶格能越大,形成的离子晶体越稳定,而且熔点越高,硬度越大。 [自学]科学视野-岩浆晶出规则与晶格能 [问题]1、什么是岩浆晶出? 3、可得用X射线衍射仪鉴别。 |
|
||||||||||
|
教学回顾: |
|||||||||||
教 案
|
课题:第三章 第一节 晶体常识(2) |
授课班级 |
|
|||||
|
课 时 |
|
||||||
|
教 学 目 的 |
知识 与 技能 |
掌握晶体与晶胞的关系、会通过晶胞确定晶体的化学式 |
|||||
|
过程 与 方法 |
学会判断晶体的化学式以及计算晶胞中所含的微粒数目的方法,提高逻辑思维能力和空间想象能力 |
||||||
|
情感 态度 价值观 |
了解人类探索物质结构的价值,认同“物质结构的探索是无止境的”观点,认识在分子等层次研究物质的意义。 |
||||||
|
重 点 |
通过晶胞确定晶体的化学式 |
||||||
|
难 点 |
晶胞的结构 |
||||||
|
知 识 结 构 与 板 书 设 计 |
二、晶胞 1、晶胞:描述晶体结构的基本单元。 2、晶胞中原子占有率:顶点:1/8;边心:1/4;面心:1/2;体心:1。 3、三种典型的立方晶体结构 |
||||||
|
教学过程 |
|||||||
|
教学步骤、内容 |
教学方法、手段、师生活动 |
||||||
[投影]蜂巢、铜晶体及铜晶胞模型: [讲]为了描述晶体在微观空间里原子的排列,无须画出千千万万个原子,只需在晶体微观空间里取出一个基本单元即可。这种描述晶体结构的基本单元叫做晶胞。可用蜂巢和蜂室的关系比喻晶体和晶胞的关系。 [板书]二、晶胞 1、晶胞:描述晶体结构的基本单元。 [讲]铜晶体的排列方式:整块晶体可以看作是数量巨大的晶胞“无隙并置”而成;所谓“无隙”,是指相邻晶胞之间没有任何间隙;所谓“并置”,是指所有晶胞都是平行排列的,取向相同。 [设问]铜晶胞含有4个铜原子,为什么不是14个? [讲] 我们在观察晶胞图时,千万不能忘记,晶胞只是晶体微观空间里的一个基本单元,在它的上下左右前后无隙并置地排列着无数晶胞,而且所有晶胞的形状及其内部的原子种类、个数及几何排列是完全相同的。因而,晶胞的顶角原子是8个晶胞共用的,晶胞棱上的原子是4个晶胞共用的,晶胞面上的原于是两个晶胞共用的。 [投影]3-8学生探究晶胞占有原子的规律: 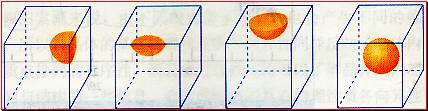 [板书]2、晶胞中原子占有率:顶点:1/8;边心:1/4;面心:1/2;体心:1。 [讲]非长方体形晶胞中粒子对晶胞的贡献视具体情况而定的。如石墨晶胞第一层内碳原子排成六边形,其顶点(1个碳原子)对六边形的贡献为1/3 [投影探究] 图3-9依次是金属钠(Na)、金属锌(Zn)、碘(12)、金刚石(C)晶胞的示意图,数一数,它们分别平均含几个原子? 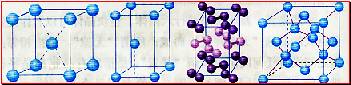 [投影]钠、锌晶胞都是:8×1/8+1=2;碘:(8×1/8+6×1/2)×2=8;金刚石:8×1/8+6×1/2+4=8。 [思考]上述铜晶体、金刚石、CO2晶体、NaCl晶体的晶胞的空间构型呈什么形状?在上述晶体中,晶胞是如何排列的?晶胞之间是否有空隙? [板书]3、三种典型的立方晶体结构: [讲](1)六方晶胞:在六方体顶点的微粒为6个晶胞共有,在面心的为2个晶胞共有,在体内的微粒全属于该晶胞。微粒数为:12×1/6 + 2×1/2 + 3 = 6 (2)面心立方:在立方体顶点的微粒为8个晶胞共有,在面心的为2个晶胞共有。微粒数为:8×1/8 + 6×1/2 = 4 (3)体心立方:在立方体顶点的微粒为8个晶胞共享,处于体心的金属原子全部属于该晶胞。微粒数为:8×1/8 + 1 = 2 [投影小结] 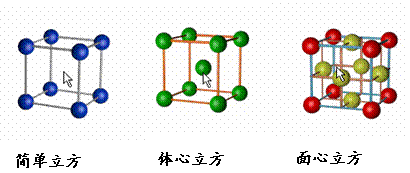  [随堂练习] 1、现有甲、乙、丙、丁四种晶胞如下图所示,可推知:甲晶体中A与B的离子个数比为 ;乙晶体的化学式为 ;丙晶体的化学式为______;丁晶体的化学式为___ ___。 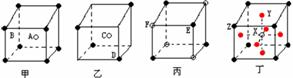 2、下图依次是金属钠(Na)、金属锌(Zn)、碘(12)、金刚石(C)晶胞的示意图,数一数,它们分别平均含几个原子? 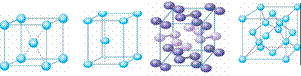  3、钙-钛矿晶胞结构如右图所示。观察钙-钛矿晶胞结构,求该晶体中,钙、钛、氧的微粒个数比为多少? 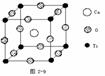 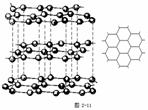 4、在碳单质的成员中还有一种混合型晶体--石墨,如图所示。它是层状结构,层与层之间依靠作用力相结合。每层内部碳原子与碳原子之间靠作用力相结合,其键角为120ْ。分析图中每个六边形含有 个碳原子。 4、在碳单质的成员中还有一种混合型晶体--石墨,如图所示。它是层状结构,层与层之间依靠作用力相结合。每层内部碳原子与碳原子之间靠作用力相结合,其键角为120ْ。分析图中每个六边形含有 个碳原子。5、右图是NaCl晶胞示意图,晶胞中Na+和Cl¯的个数比是多少? 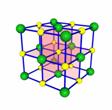 6、右图是CO2分子晶体的晶胞结构示意图,其中有多少个原子? 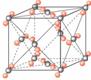 |
|
||||||
|
教学回顾: |
|||||||
2、可得用宝石的折光率鉴别。
2、利用晶体与非晶体的性质差别来鉴别玻璃和宝石。宝石是晶体,具有固定的熔点和各向异性,可用硬度、熔点、折光率等性质来鉴别宝石。
[投影]1、可观察宝石的形状,具有多面体的外形,实验它的硬度,可在玻璃上划出痕迹,初步确定它是晶体。
2.根据晶体物理性质的各向异性的特点,人们很容易识别用玻璃仿造的假宝石。你能列举出一些可能有效的方法鉴别假宝石吗?
[投影]玻璃的结构示意图
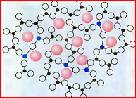
[汇报]1、晶体与非晶体的根本区别在于构成固体中的粒子在微观空间是否呈现周期性的有序排列。观察玻璃的结构示意图可知,构成玻璃的粒子无周期性排列,是无序的,所以玻璃是非晶体。
46.(共5分)(1)54%(2分) (2)3mol/L(3分)(计算过程略)
45.(共5分)①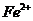 具有氧化性(1分)
具有氧化性(1分)
②在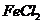 溶液中滴入适量氯水(1分) 溶液由浅绿色变为棕黄色(1分)
溶液中滴入适量氯水(1分) 溶液由浅绿色变为棕黄色(1分)
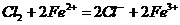 (2分)
(2分)
44.(共5分)(1)羧基(1分)
(2)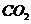 (1分)
(1分)
(3)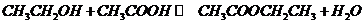 (2分)
(2分)
酯化(或取代)(1分)
43.(共5分)(1)ⅣA(1分) (2)HF(1分) (3)Mg(1分)
(4)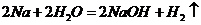 (2分)
(2分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com