
1.(2005年·辽宁大连)某洗涤剂的pH为12,向其中滴入2滴酚酞试液,溶液的颜色呈( )
A.红色 B.紫色 C.蓝色 D.无色
3.对以中和反应为原理的化学计算,忽视对基本计算题型的方法选择、步骤格式、数字处理等。
对涉及到中和反应的试题,要注意对以下细微的知识点的积累和理解:①概念问题:如对酸碱中和反应的理解以及中和反应产物-盐的理解;对溶液酸碱性和酸碱度的区别;②实验问题:如对酸碱中和反应的实验探究、溶液pH的测定的实验操作等;③应用问题:如对酸碱中和反应在实际中的应用、溶液酸碱度在实际中的意义等;④计算问题:以中和反应为原理的计算,要将中和反应和常见的计算题的呈现形式和常规题型结合起来;⑤综合问题:如将酸碱中和反应和溶液pH值的变化相结合,综合考查化学计算和图像分析的能力。
[基础演练]
2.忽视对中和反应多角度、多层次的认识,如对有关中和反应的发生与否以及程度大小的探究不能结合中和前后溶液的酸碱性和化学性质进行实验方案的设计;对中和反应前后溶液的pH变化不能根据溶液成分的变化进行分析和推断。
对中和反应的认识要从多方面进行,例如氢氧化钠溶液和盐酸的中和反应:NaOH+HCl=NaCl+H2O,可以从反应物的定量关系进行认识,这是化学计算的基础;从实验现象改进进行认识,这是实验探究和方案设计的基础;从实际中的应用进行认识等等。
1.忽视对基本概念的理解和区别,如酸性溶液和酸溶液、碱溶液和碱性溶液、溶液的酸碱性和酸碱度等易混淆概念。不注重易混淆概念的区别,很容易出现知识的错误迁移,如根据“酸溶液呈酸性,碱溶液呈碱性”推导出“盐溶液呈中性”;根据酸“在水溶液中能解离出H+和酸根离子”推导出“在水溶液中能解离出H+的是酸”(如NaHSO4=Na++H++SO42-)。
5.以酸碱中和反应的原理为载体,考查化学计算的能力,如例5;
[典例精析]
例1:(2005年·广东汕头)下表是常用物质的主要成分及其溶液的pH:
|
编号 |
① |
② |
③ |
④ |
|
常用物质 |
食醋 |
白酒 |
石灰水 |
纯碱 |
|
主要成分 |
CH3COOH |
C2H5OH |
Ca(OH)2 |
Na2CO3 |
|
pH |
3 |
7 |
11 |
10 |
请按下列要求将表中对应物质的编号填入空格处:
(1)属于酸的是_____________,属于碱的是___________,属于盐的是___________。
(2)黄蜂毒刺呈碱性,若某人被黄蜂蜇了,可用上述____________物质涂在皮肤上。
解析 本题要求根据常用物质的主要成分和溶液的pH对物质类别进行判断。在判断时不能仅仅根据溶液的pH进行判断,因为酸溶液的pH<7,碱溶液的pH<7,但盐溶液的pH不一定等于7,还要结合物质的主要成分。
答案:(1)①,③,④(2)①
例2:(2005年·甘肃兰州) 甲、乙、丙分别是酸或碱的水溶液,pH值依次为1,5,14。下列图形合理的是( )
A.图(1)表示甲中滴入丙 B.图(2)表示乙中滴入丙
C.图(3)表示丙中滴入乙 D.图(4)表示甲中滴入乙
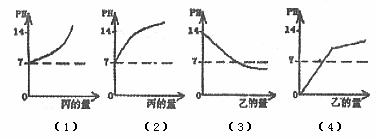
解析 根据甲、乙、丙溶液的pH可以判断出分别为酸、酸、碱。甲中滴入丙,pH逐渐变大,但小于14;乙中滴入丙,pH逐渐变大,但小于14;丙中滴入乙,pH逐渐减小,但大于5;甲中滴入乙,pH逐渐变大,但始终小于5。
答案:C
例3:(2005年·江西省课改实验区)如图所示,小娟同学在进行酸碱中和反应的实验时,向烧杯的氢氧化钠溶液滴加稀盐酸一会儿后,发现忘记了滴加指示剂。为了确定盐酸与氢氧化钠是否恰好完全反应,小娟从烧杯中取少量反应后的溶液于一支试管中,并向试管中滴加几滴无色酚酞试液,振荡,观察到酚酞试液不变色。于是她得出“两种物质已恰好完全中和”的结论。
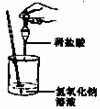
(1)你认为她得出的结论是否正确_____ ;理由是
______________________________
(2)写出该中和反应的化学方程式___________ ____ __。
(3)请你另设计一个实验,探究上述烧杯中的溶液是否恰好完全中和,填写下表:
|
实验方法 |
可能观察到的现象 |
结论 |
|
|
|
|
解析 本题要求设计实验对盐酸和氢氧化钠发生中和反应的程度(即盐酸加入量的多少)进行判断。在进行实验设计时可结合中和前后溶液的酸碱性变化或者主要成分,利用酸碱指示剂或者酸、碱的性质进行中和反应程度的判断。盐酸和氢氧化钠恰好中和或者盐酸过量的区别在于中和后溶液的成分和酸碱性不同。显然小娟的结论不正确,
答案:(1)不正确 如果盐酸过量,滴如酚酞也不会变色(2)NaOH+HCl=NaCl+H2O(3)(以下方法任写一种均可得分)
|
①取样,滴加紫色石蕊试液 |
试液变红 |
盐酸过量 |
|
②取样,滴加紫色石蕊试液 |
试液不变红 |
恰好中和 |
|
③取样,滴加碳酸钠溶液 |
有气泡产生 |
盐酸过量 |
|
④取样,滴加碳酸钠溶液 |
无气泡产生 |
恰好中和 |
|
⑤取样,加入锌粒等活泼金属 |
有气泡产生 |
盐酸过量 |
|
⑥取样,加入锌粒等活泼金属 |
无气泡产生 |
恰好中和 |
例4:(2005年·广东汕头)胃酸的主要成分是盐酸,胃酸过多会引起胃痛。下图是一种治疗胃病药物的标签。

请回答:
(1)该药物的主要作用是_________________,这种药物在胃中发生反应的化学方程式是______________________________________。
(2)胃痛时吃几块苏打饼干(含纯碱)可减轻胃痛,该反应的化学方程式是:_________________________________________________________。
解析 本题考查了酸碱中和反应的实际应用-治疗胃病。根据该药物的标签标明的主要成分,可以判断出药物的作用为中和胃酸。胃痛时服用苏打饼干减轻胃痛是利用盐酸和苏打的反应较少胃中胃酸的量。
答案:中和胃液中过多的盐酸 Al(OH)3+3HCl=AlCl3+3H2O(2)Na2CO3+2HCl=2NaCl+H2O+CO2↑
例5:(2005年·广东茂名)人胃酸(主要成分是盐酸)过多,会引起很胃病。下图为某抗酸药包装标签上的部分文字,请回答下列问题。

(1)该药“嚼啐后吞服”的原因是___________________。
(2)某同学为测定该药中氢氧化铝的质量分数进行如下操作:取一片药片(药片质量为0.5g)研碎后加20mL蒸馏水,然后用质量分数为5%,密度为1.02g/mL的盐酸进行反应(假充其它成分不与盐酸反应),测得实验中反应掉的盐酸体积为6.0mL,通过计算:
①判断该药片中氢氧化铝的含量是否达到标注?
②确定该药片中氢氧化铝的质量分数是多少?
解析 本题以抗酸药中成分含量测定为载体,考查了酸碱中和反应在实际中的应用和化学计算的能力。将药物“嚼啐后吞服”,主要是增大反应物的接触面积,加快与胃酸作用。
设药片中氢氧化铝质量为x。根据测定的化学反应:Al(OH)3+3HCl=AlCl3+3H2O,结合反应消耗的盐酸的量,有:78:3×36.5=x:1.02g/ml×6.0ml×5%
解得x=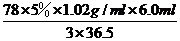 =0.218g
=0.218g
因为氢氧化铝的实际质量为218mg,小于标签所标识的250mg。故药品中的氢氧化铝含量没有达到标准。
药品中氢氧化铝的质量分数为: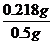 ×100%=43.6%。
×100%=43.6%。
答案:(1)增大反应物的接触面积,加快与胃酸作用(2)①没有达到标准②43.6%
[常见误区]
4.以酸碱中和反应的原理为载体,考查酸碱中和反应在实际中的应用,如例4;
3.以酸碱中和反应的实验为载体,对酸碱中和反应的发生与否以及程度大小进行实验判断和验证,如例3;
1.根据pH值及其大小对溶液进行溶液酸碱度的比较和物质类别的判断,如例1; 2.以过程或反应中的pH变化为载体,进行反应过程和pH图像综合性分析,如例2;
3.理解溶液的酸碱度的表示方法-pH,了解溶液的酸碱度在实际中的意义。
2.了解中和反应在实际中的应用;
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com