
4.(2010·南京模拟).研究发现,空气中少量的NO2能参与硫酸型酸雨的形成,反应过程如下:
①SO2+NO2→SO3+NO ②SO3+H2O→H2SO4 ③2NO+O2→2NO2
NO2在上述过程中的作用,与H2SO4在下列变化中的作用相似的是( )
A.加入少量H2SO4使淀粉水解
B.碳酸钠与硫酸反应
C.向铜和双氧水的混合物中加入硫酸
D.潮湿的氯气通过盛有浓H2SO4的洗气瓶
[解析]选A。观察题干信息可知,NO2起到了催化剂的作用,A选项中H2SO4起了催化剂的作用;B、C选项中H2SO4作为反应物;D选项中浓H2SO4起到了干燥剂的作用,A选项符合题意。
3.(2010·龙岩模拟)亚硝酸(HNO2)及其钠盐参加反应时既可作氧化剂又可作还原剂。当它们作还原剂时,生成的含氮产物可能是( )
A.NO B.N2 C.NO2 D.NH3
[解析]选C。当亚硝酸(HNO2)及其钠盐作还原剂时,氮元素的化合价只能升高,因此选C选项。
2.(2010·福建师大附中模拟)相同质量的铜片分别与过量的体积相同的浓硝酸、稀硝酸反应。二者比较,相等的是( )
①铜片消耗完所需时间; ②反应生成的气体体积(标准状况);
③反应中氧化剂得到的电子总数; ④反应后溶液中铜离子的浓度
A.①③ B.②④ C.③④ D.只有①
[解析]选C。硝酸的浓度越大,反应速率越快,消耗时间越少;1mol Cu与足量的浓硝酸反应会生成2mol NO2, 1mol Cu与足量的稀硝酸反应会生成2/3 mol NO;参加反应的铜的质量相同,因此氧化剂得到的电子也相同;由于铜元素守恒,反应后溶液中铜离子的浓度也相同。
1.(2010·荆门模拟)13.8g 63%的HNO3溶液(密度为1.38g•cm-3)和100mL 13.8 mol/L的HNO3溶液相比,正确的是( )
A.都应用棕色广口瓶存储 B.浓度不同的两种HNO3溶液
C.溶液的体积不同但浓度相同 D.均可与Au反应而发生钝化现象
[解析]选C。浓硝酸应该盛放在棕色细口瓶中,因此A选项错误;前者根据公式c=1000ρw%/M可以计算出物质的量浓度为13.8 mol/L,因此两者浓度相同,B选项错误;C选项正确;浓硝酸不与Pt、Au反应,室温下浓硝酸能够使铁、铝钝化因此D选项错误。
3.红外光谱仪
用途 。
试题枚举
[例1] 下列实验中所选用的仪器合理的是( )
A. 用200mL量筒量取5.2mL稀硫酸
B. 用250mL容量瓶配制250mL0.2mol/L的氢氧化钠溶液
C. 用托盘天平称量11.7克氯化钠晶体
D. 用碱式滴定管量取25.1mL溴水
解析:这是一道考查称量仪器使用的题目。选用量筒时应注意选合适规格,量取5.2mL稀硫酸要用10mL量筒,所以A不正确;滴定管量取液体时应精确到0.01mL,所以D不正确。
托盘天平可称量精确到0.1克,一般配制多大体积的溶液就选用多大体积的容量瓶。
答案: BC
[变式]准确量取25.00 mL高锰酸钾溶液,可选用的仪器是 ( C )
A . 50 mL量筒 B. 10 mL量筒 C. 50 mL酸式滴定管 D. 50mL碱式滴定管
[例2] 一支40mL碱式滴定管注入苛性钠溶液后,液面正好在10mL刻度处,则苛性钠溶液体积为 ( )
A . 10mL B. 大于10mL C. 30 mL D. 大于30 mL
解析:滴定管的0刻度线在上方,40mL刻度线下至尖嘴处仍有溶液,所以大于30 mL
答案:D
[变式]下列量器和温度计的刻度表示正确的是(CD)
A.量筒的刻度值是由下向上增大,“0”刻度在下
B.250毫升容量瓶上一般刻有30℃250毫升的标记
C.滴定管的刻度值由上而下增大,“0”刻度在上
D.温度计的刻度是由下而上增大,“0”在有刻度标记区域
[例3] 现有下列仪器或用品:①铁架台(含铁圈,各种铁夹);②锥形瓶;③酸式滴定管与碱式滴定管;④烧杯(若干);⑤玻璃棒;⑥胶头滴管;⑦天平(含砝码);⑧滤纸;⑨量筒;⑩过滤漏斗。
(1)过滤时,应选用的上述仪器是 (填编号)。
(2)配制一定物质的量浓度的溶液时,还缺少的仪器是 。
(3)在中和滴定使用滴定管前,首先应 。
解析 这类试题的解题方法是首先看题目选项的具体操作。联想该操作的仪器、方法、注意事项等,对比题目中所给的仪器进行组合,看仪器是否完全具备进行某一项实验,这样才能得出正确结论,有时试题是给出一些仪器来完成某些实验操作,而所给的仪器不全,其解题方法与之类似,即通过联想完成。
答案 (1)过滤所用的仪器有:铁架台、烧杯、玻璃棒、滤纸、过滤漏斗。
(2)配制一定物质的量浓度的仪器有:天平(含砝码)、容量瓶、烧杯、玻璃棒、胶头滴管。
(3)检查活塞是否漏水,在确保不漏水后方可使用。
2.核磁共振仪
用途 。
1.质谱仪
用途 。
2. 性质: 。
试题枚举
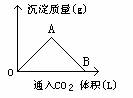 [例1]右图为一定量饱和Ca(OH)2溶液中通入CO2气体后,产生CaCO3白色沉淀的质量与CO2体积的关系曲线,试回答:
[例1]右图为一定量饱和Ca(OH)2溶液中通入CO2气体后,产生CaCO3白色沉淀的质量与CO2体积的关系曲线,试回答:
(1)OA段曲线与AB段曲线所表示的反应方程式为OA:__________,AB_____________。
(2)A点已参加反应的CO2和Ca(OH)2的物质的量之比为______________。
(3)B处溶液中存在的浓度较大的两种离子是_______和________(填离子符号),将B处生成的溶液煮沸可见到的现象是_______________
解析:CO2与Ca(OH)2反应,CO2的量直接影响产物的生成,图形较清楚地反映了这一关系,依据有关反应原理:
CO2(少)+Ca(OH)2== CaCO3↓+H2O ,
AB段:CO2+CaCO3+H2O== Ca(HCO3)2
便可判断图形中各段所发生的反应,OA段随着CO2继续通入CaCO3的量逐渐增大,A点达到沉淀最大值,AB段随CO2的继续通入,生成的CaCO3不断溶解转化为Ca(HCO3)2,B点CaCO3全溶解,溶液又变得澄清。
答案:(1)OA段:CO2+Ca(OH)2== CaCO3↓+H
AB段:CO2+CaCO3+H2O== Ca(HCO3)2
(2)A点:n(CO2)∶n[Ca(OH)2]=1∶1
(3)Ca2+ HCO3- 因Ca(HCO3)2受热分解,溶液变浑浊,有气泡逸出。
[例2]下列关于硅的说法不正确的是 ( )
A.硅是非金属元素,但它的单质是灰黑色有金属光泽的固体
D.硅的导电性能介于金属和绝缘体之间,是良好的半导体材料
C硅的化学性质不活泼,常温下不与任何物质起反应
D.当加热到一定温度时,硅能与氧气、氢气等非金属反应
解析: 常温下,硅可与氟气、氢氟酸、强碱溶液反应,加热和高温条件下,硅能与氧气、氢气起反应。选C。
答案: C
[例3]石墨炸弹爆炸时能在方圆几百米范围内撒下大量石墨纤维,造成输电线、电厂设备破坏。这是由于石墨( )
A . 有放射性 B. 易燃、易爆 C. 能导电 D. 有剧毒
解析:利用了石墨的导电性能,石墨纤维落在输电线上,造成线路短路,发电机和其他设施损坏。石墨性质稳定,无毒也不易燃、易爆。
答案: C
1. 制法: 。
3.化学性质:(1)酸性氧化物:与强碱反应:
离子方程式: (保存碱性溶液不能用橡胶塞)。与碱性氧化物反应: 。
(2)与HF反应: (唯一与其反应的酸)。
4,用途:(1)制造光导纤维
(2)石英坩埚
(3)光学仪器和工艺品
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com