
14.(2010·厦门模拟)下列物质有如下转化关系(有的生成物未列出),其中:D为碱,G为酸,金属甲在G 的浓溶液中会钝化;F的溶液中只含一种溶质。
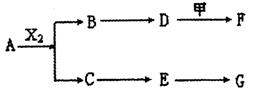
A、B、C、D、E均由Q、R、X、T四种短周期元素中的两种或三种组成,且Q、R、X、T原子序数依次增大;X的最外层电子数是电子层数的3倍;R和X相邻;Q和T同主族,Q为非金属元素,T为金属元素。则:
(1)X在周期表中的位置是 ,R、X、T的原子半径从小到大的顺序为
(用元素符号表示);
(2)A和G等物质的量反应产物的水溶液显 性,其原因用离子方程式表示为 ;
(3)A和X2反应的化学方程式为 ;
(4)pH均为12的D溶液和F溶液中,水电离出的c(OH-)之比为 ;
(5)为保护环境,通过安装汽车尾气处理装置,使尾气中的E和CO反应转化为两种空气的成分,当反应转移l mol电子时,生成的气体在标准状况下的总体积为 L。
[答案]
(1)第二周期VIA族;O N Na
|

 NH3·H2O+H+
NH3·H2O+H+
|
(4)1:1010(或10-10,10-10:1)
(5)14
13.(2010·天津和平区模拟)已知A为常见金属,X、Y为常见非金属,X、E、F、G常温下为气体,C为液体,B是一种盐,受热极易分解,在工农业生产中用途较广(如被用作某些电池的电解质)。现用A与石墨作电极,B的浓溶液作电解质,构成原电池。有关物质之间的转化关系如下图:(注意:其中有些反应的条件及部分生成物被略去)
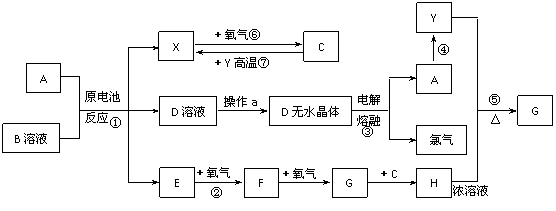

请填写下列空白:
(1)反应④为A在某种气体中燃烧,生成单质Y和A的氧化物,其反应方程式为
。
(2)从D溶液制备D的无水晶体的“操作a”为 。
(3)反应②的化学方程式为 。
(4)反应⑤的化学方程式为 。
(5)原电池反应①中正极的电极反应式为
[答案]
 (1)2Mg+CO2
==== 2MgO+C (2)将D溶液在HCl气流中蒸干
(1)2Mg+CO2
==== 2MgO+C (2)将D溶液在HCl气流中蒸干
(3)②4NH3+5O2 ==== 4NO+6H2O

(4)⑤C+4HNO3(浓)====CO2↑+4NO2↑+2H2O
(5)2NH4++2e- ==== 2NH3↑+H2↑
12.(2010·烟台模拟)下列说法不正确的是 ( )
A.当镀锡铁制品的镀层破损后,镀锡铁比镀锌铁更耐腐蚀,镀层能对铁制品起电化学保护作用
B.离子化合物中可以不含金属元素
C.12C和14C互为同位素,而C60与C70互为同素异形体
D.若硝酸与锌反应还原的产物为N2O,被还原硝酸与未被还原硝酸的物质的量之比为1:4
[解析]选A。镀锡铁制品的镀层破损后,形成原电池,铁比锡活泼,铁做负极失电子易被氧化;镀锌铁制品的镀层破损后,形成原电池,锌比铁活泼,铁做正极,受到保护,因此A选项错误;铵盐属于离子化合物不含金属元素,B选项正确;12C和14C互为同位素,而C60与C70互为同素异形体,C选项正确;假设生成1mol的N2O,xmol锌参与反应,由得失电子相等:1×2×(5-1)=2x x=4 mol 生成硝酸锌的物质的量为4 mol,n(被还原硝酸):n(未被还原硝酸)=1×2:4×2=1:4,D选项正确。
11.(2010·台州模拟) 如图,同温同压下,两个等体积的干燥圆底烧瓶中分别充满①NH3、②NO2,进行喷泉实验。经充分反应后,瓶内溶液的物质的量浓度为( )
A.①>② B.①<② C.①=② D.不能确定
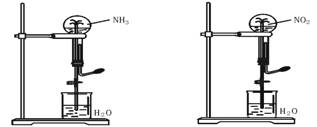
[解析]选C。假设两个容器的状况为标准状况,①中物质的量浓度计算公式为c=(VL÷22.4 L·mol-1)
÷VL=1/22.4 mol·L-1 ②中物质的量浓度计算公式为c=(2/3×V/22.4)mol÷2/3L=1/22.4 mol·L-1 因此C选项正确。
10.(2010·济南模拟)向一定量的Fe、FeO、Fe2O3、Fe3O4的混合物中加入150mL4 mol·L-1的稀硝酸恰好使混合物完全溶解,放出2.24LNO(标准状况),往所得溶液中加入KSCN溶液,无红色出现。若用足量的H2在加热条件下还原相同质量的混合物,所得到的铁的物质的量为( )
A.0.21mol B.0.25mol C.0.3mol D.0.35mol
[解析]选B。稀硝酸恰好使混合物完全溶解,加入KSCN溶液,无红色出现,说明铁元素在溶液中以Fe(NO3)2形式存在,根据氮元素守恒可以求出n[Fe(NO3)2]=[0.15L×4 mol·L-1-2.24L÷22.4L·mol-1]
÷2=0.25mol,再由铁元素守恒,可以知用足量的H2在加热条件下还原相同质量的混合物,所得到的铁的物质的量为0.25mol
9.(2010·台州模拟)1.28g Cu完全溶于一定量的浓HNO3中,生成的气体刚好充满500mL的烧瓶,然后将该烧瓶倒置于水中,缓缓通入一定量的氧气后容器内刚好充满水,则通入的氧气为( )
A.0.16g B.0.02mol C.0.32g D.0.224g
[解析]选C。铜失去的电子给了硝酸,然后硝酸被还原为氮氧化物,氮氧化物与氧气反应,氮氧化物又把电子给了氧气,相当于铜直接把电子给了氧气;由得失电子相等可以计算,n(失电子)=n(得电子),n(Cu)×2=n(O2)×4,(1.28÷64)×2= n(O2)×4, n(O2)=0.01mol,m(O2)=0.01mol×32g/mol=0.32g,因此C选项正确。
8.(2010·长沙模拟)a mol FeS与b mol FeO投入到VL、c mol/L的硝酸溶液中充分反应,产生NO气体,所得澄清溶液成分可看作是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为( )
①(a+b)×63g ②(a+b)×189g ③(a+b)mol ④Vc-(9a+b)/3mol
A.①④ B.②③ C.①③ D.②④
[解析]选D。在此反应中硝酸分两部分参加反应即硝酸的总量=被还原的硝酸的量+未被还原的硝酸的量,由铁原子守恒和氮原子守恒可知n(未被还原的硝酸)=3n[Fe(NO3)3],m(未被还原的硝酸)=(a+b)×3×63=(a+b)×189g;由得失电子相等可以求出被还原的硝酸的物质的量:a×(3-2)+a×[6-(-2)]+b×(3-2)=n(被还原的硝酸)×(5-2) n(被还原的硝酸)= (9a+b)/3mol,n(未被还原的硝酸)=n(总硝酸)-n(被还原的硝酸)= Vc-(9a+b)/3mol因此D选项正确。
7.(2010·姜堰模拟)下列叙述正确的是( )(用NA代表阿伏加德罗常数的值)
A.2.7g金属铝变为铝离子时失去的电子数为0.3NA
B.标准状况下,5.6L一氧化氮和5.6L氧气混合后的气体中分子总数为0.5NA
C.在标准状况下,体积均为22.4L的CH4与H2O所含有的电子数均为10NA
D.CO和N2为等电子体,22.4L的CO气体与1molN2所含的电子数相等
[解析]选A。Al→Al3+,0.1mol Al失去0.3mol的电子,A选项正确;一氧化氮和氧气反应会生成二氧化氮,混合后分子总数会小于0.5NA,B选项错误;标况下水是液体,C选项错误;D选项未给出标况下,22.4L的CO气体可能不是1molCO,因此D选项错误。
6.(2010·南京模拟)下列有关工业生产的叙述中,错误的是 ( )
A.制普通玻璃的主要原料是纯碱、石灰石、石英
B.氨是制作氮肥、硝酸、铵盐的重要原料
C.将二氧化硫催化氧化生成三氧化硫后,在吸收塔内用水吸收制得浓硫酸
D.炼铁的主要原理是在高温下,用还原剂从铁矿石中把铁还原出来
[解析]选C。如果吸收塔内用水吸收三氧化硫会形成酸雾,工业上是用浓硫酸来吸收三氧化硫。
5.(2010·湖南师大附中模拟)在常温常压下,在a、b、c、d四支相同的试管中,分别装入等物质的量混合的两种气体。a试管内是NO2和O2;b试管内是Cl2和SO2;c试管内是NO和O2;d试管内是CO和O2。将四支试管迅速同时倒立于水中,最后水面上升高度h的比较正确的是( )
A、b>c>a>d B、 c>a>b>d C、d>a>c>b D、b>a>c>d
[解析]选A。假设试管中的气体分别为1mol ,那么试管a中剩余3/4mol 的O2, 试管b中无气体剩余, 试管c中剩余1/4mol 的O2,试管d中CO和O2均难溶于水,试管中剩余气体越少水面上升高度越高,因此A选项正确。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com