
2.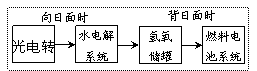 下图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH为电解液,下列有关说法中不正确的是( )
下图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH为电解液,下列有关说法中不正确的是( )
A.该能量转化系统中的水也是可以循环的
B.燃料电池系统产生的能量实际上来自于水
C.水电解系统中的阳极反应:4OH--4e-=2H2O+O2↑
D.燃料电池放电时的负极反应:H2-2e-+2OH-=2H2O
例15.(09广东化学14)可用于电动汽车的铝-空气燃料电池,通常以NaCl溶液或NaOH
溶液为电解液,铝合金为负极,空气电极为正极。下列说法正确的是
A.以NaCl溶液或NaOH溶液为电解液时,正极反应都为:O2+2H2O+4e-=4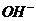
B.以NaOH溶液为电解液时,负极反应为:Al+3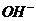 -3e-=Al(OH)3↓
-3e-=Al(OH)3↓
C.以NaOH溶液为电解液时,电池在工作过程中电解液的pH保持不变
D.电池工作时,电子通过外电路从正极流向负极
[解析]电解质溶液显碱性或中性, 该燃料电极的正极发生反应为:O2+2H2O+4e-=4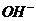 ,A对;铝作负极,负极反应应该是铝失去电子变为铝离子,在氢氧化钠的溶液中铝离子继续与过量的碱反应生成偏铝酸根,因此负极反应为:Al+4
,A对;铝作负极,负极反应应该是铝失去电子变为铝离子,在氢氧化钠的溶液中铝离子继续与过量的碱反应生成偏铝酸根,因此负极反应为:Al+4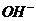 -3e=
-3e=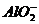 + 2H2O,B错; 该电池在碱性条件下消耗了碱,反应式为4Al+3O2+4
+ 2H2O,B错; 该电池在碱性条件下消耗了碱,反应式为4Al+3O2+4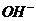 = 4
= 4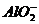 + 2H2O溶液PH降低,C错;电池工作时,电子从负极出来经过外电路流到正极,D错高
+ 2H2O溶液PH降低,C错;电池工作时,电子从负极出来经过外电路流到正极,D错高
[答案]A
例16.(09年浙江卷)市场上经常见到的标记为Li-ion的电池称为“锂离子电池”。它的负极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li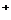 的高分子材料。这种锂离子电池的电池反应为: Li+2Li
的高分子材料。这种锂离子电池的电池反应为: Li+2Li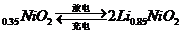
下列说法不正确的是
A.放电时,负极的电极反应式:Li-e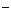 =Li
=Li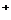
B.充电时,Li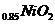 既发生氧化反应又发生还原反应
既发生氧化反应又发生还原反应
C.该电池不能用水溶液作为电解质
D.放电过程中Li 向负极移动
向负极移动
[解析]A项,Li从零价升至正价,失去电子,作为负极,正确;B项,反应逆向进行时。反应物只有一种,故化合价既有升,又有降,所以既发生氧化反应又发生还原反应,正确;C项,由于Li可以与水反应,故应为非水材料,正确;D项,原电池中阳离子应迁移至正极失电子,故错。
[答案]D
例17.(09年山东卷)Zn-MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液。
(1)该电池的负极材料是 。电池工作时,电子流向 (填“正极”或“负极”)。
(2)若ZnCl2-NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是 。欲除去Cu2+,最好选用下列试剂中的 (填代号)。
a.NaOH b.Zn c.Fe d.NH3·H2O
(3)MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液。阴极的电极反应式是 。若电解电路中通过2mol电子,MnO2的理论产量为 。
[解析](1) 负极上是失电子的一极 Zn失电子有负极经外电路流向正极。(2)锌与还原出来的Cu构成铜锌原电池而加快锌的腐蚀。除杂的基本要求是不能引入新杂质,所以应选Zn将Cu2+ 置换为单质而除去。(3)阴极上得电子,发生还原反应, H+得电子生成氢气。因为MnSO4-MnO2-2 e-,通过2mol电子产生1molMnO2,质量为87g。
[答案]
(1)Zn(或锌) 正极 (2)锌与还原出来的Cu构成铜锌原电池而加快锌的腐蚀
b (3)2H++2e-→H2 ,87g
[专题突破]
1.(长春市实验中学2009届高三理科综合)钢铁在潮湿的空气中会被腐蚀,发生的原电池反应:2Fe+2H2O+O2  2Fe2++4OH-。以下说法正确的是
( )
2Fe2++4OH-。以下说法正确的是
( )
A.负极发生的反应为:Fe-2e- Fe2+
Fe2+
B.正极发生的反应为:2H2O+O2+2e- 4OH-
4OH-
C.原电池是将电能转变为化学能的装置
D.钢柱在水下部分比在空气与水交界处更容易腐蚀
例13. 将两个铂电极插入500mL CuSO4溶液中进行电解,通电一定时间后,某一电极增重0.064g(设电解时该电极无氢气析出,且不考虑水解和溶液体积变化),此时溶液中氢离子浓度约为
A.4×10-3mol/L B.2×10-3mol/L C.1×10-3mol/L D.1×10-7mol/L
[解析]根据电解规律可知阴极反应:Cu2++2e-=Cu,增重0.064gCu,应是Cu的质量,根据总反应方程式:
2CuSO4+2H2O 2Cu+O2↑+2H2SO4--->4H+
2Cu+O2↑+2H2SO4--->4H+
2×64g 4mol
0.064g x
x=0.002mol
[H+]=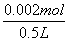 =4×10-3mol/L
=4×10-3mol/L
[答案]A
例14.(2009届福建省泉州市俊来中学高三年级月考化学)电解100mL含c(H+)=0.30mol/L
的下列溶液。当电路中通过0.04mol电子时,理论上析出金属质量最大的是
A.0.10mol/L Ag+ B.0.20mol/L Zn2+ C.0.20mol/L Cu2+ D.0.20mol/L Pb2+
[解析]电解时阴极上溶液中离子的反应顺序为Ag+ >Cu2+ >H+ >Pb2+ >Zn2+ ,
A项中Ag+ 先反应,H+后反应,可得到Ag:0.10mol/L×0.1L×108g/mol=1.08g ;H2 :0.03g 。
B项中H+先反应,Zn2+后反应,可得H2:0.03g ;Zn:(0.04mol-0.03mol)÷2×65g/mol=0.325g 。
C项中Cu2+先反应,H+后反应,可得到Cu:0.02mol/L×0.1L×64g/mol=1.28g 。D项中H+先反应,Pb 2+后反应,可得到H2:0.03g ;Pb:(0.04mol-0.03mol)÷2×207g/mol=1.05g 。
因此理论上析出金属质量最大的是C。
[答案]C
例11.银器皿日久表面逐渐变黑色,这是由于生成硫化银,有人设计用原电池原理加以除去,其处理方法为:将一定浓度的食盐溶液放入一铝制容器中,再将变黑的银器浸入溶液中,放置一段时间后,黑色会褪去而银不会损失。试回答:在此原电池反应中,负极发生的反应为________;正极发生的反应为_________;反应过程中产生有臭鸡蛋气味的气体,则原电池总反应方程式为___________________________。
[解析]要善于抓住题示信息,“黑色褪去而银不会损失”,必然发生变化:Ag2S Ag,
Ag,
显然这是原电池的正极反应,Ag2S+2e-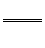 2Ag+S2-,负极反应为活泼金属发生氧化反应:Al-3e-
2Ag+S2-,负极反应为活泼金属发生氧化反应:Al-3e-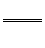 Al3+。正极生成的S2-和负极生成的Al3+在溶液中发生双水解:2Al3++3S2-+6H2O
Al3+。正极生成的S2-和负极生成的Al3+在溶液中发生双水解:2Al3++3S2-+6H2O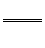 2Al(OH)3↓+3H2S↑,与题意产生臭鸡蛋气味的气体相吻合。原电池的总反应为上述三个反应的加合:3Ag2S+2Al+6H2O
2Al(OH)3↓+3H2S↑,与题意产生臭鸡蛋气味的气体相吻合。原电池的总反应为上述三个反应的加合:3Ag2S+2Al+6H2O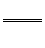 6Ag+2Al(OH)3↓+3H2S↑。
6Ag+2Al(OH)3↓+3H2S↑。
[答案]Al-3e-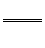 Al3+ Ag2S+2e-
Al3+ Ag2S+2e-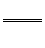 2Ag+S2-
2Ag+S2-
3Ag2S+2Al+6H2O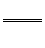 6Ag+2Al(OH)3↓+3H2S↑
6Ag+2Al(OH)3↓+3H2S↑
例12.钢铁在很弱的酸性或中性条件下发生电化学腐蚀时,正极的反应式为 ( )
A.Fe-2e- Fe2+
B.2H++2e-
Fe2+
B.2H++2e- H2↑
H2↑
C.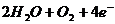
 4
4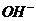 D.Fe-3e-
D.Fe-3e- Fe3+
Fe3+
[解析]钢铁中含有多种杂质,在考虑钢铁的电化学腐蚀时,为了简化问题,主要讨论碳杂质问题。也就是以Fe为负极,C为正极的原电池反应。在中性条件或弱酸性条件下发生的是吸氧腐蚀。原电池的正极为C,发生的是还原反应,即得电子反应,故A、D选项应排除。在B、C选项中,B项是析氢腐蚀的电极反应式
[答案]C
例7.下列关于金属腐蚀的叙述正确的是 ( )
A.金属在潮湿情况下的腐蚀实质是M+nH2O====M(OH)n+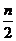 H2↑
H2↑
B.金属的化学腐蚀实质是M-ne- Mn+,电子直接转移给氧化剂
Mn+,电子直接转移给氧化剂
C.金属的化学腐蚀必须在酸性条件下进行
D.在潮湿的中性环境中,金属的电化学腐蚀主要是吸氧腐蚀
[解析]A项金属在潮湿情况下有可能进行析氢腐蚀,也有可能进行吸氧腐蚀,题目只给出了析氢腐蚀实质。C项中,金属铝的化学腐蚀可以在碱性条件下进行,故此选项错。
[答案]BD
例8.(09年广东卷)出土的锡青铜(铜锡合金)文物常有Cu2(OH)3Cl覆盖在其表面。下列说法正确的是
A. 锡青铜的熔点比纯铜高
B.在自然环境中,锡青铜中的锡对铜起保护作用
C.锡青铜文物在潮湿环境中的腐蚀比干燥环境中快
D.生成Cu2(OH)3Cl覆盖物是电化学腐蚀过程,但不是化学反应过程
[解析]锡青铜属于合金根据合金的特性,熔点比任何一种纯金属的低判断A错;由于锡比铜活泼,故在发生电化学腐蚀时,锡失电子保护铜,B正确;潮湿的环境将会加快金属的腐蚀速率,C正确;电化学腐蚀过程实质是有电子的转移,属于化学反应过程,D错。
[答案]BC
例10.(09广东理科基础25)钢铁生锈过程发生如下反应:
①2Fe+O2+2H2O=2Fe(OH)2;
②4Fe(OH)2+O2+2H2O=4Fe(OH)3;
③2Fe(OH)3=Fe2O3+3H2O。
下列说法正确的是
A.反应①、②中电子转移数目相等
B.反应①中氧化剂是氧气和水
C.与铜质水龙头连接处的钢质水管不易发生腐蚀
D.钢铁在潮湿的空气中不能发生电化学腐蚀
[解析]①②反应中消耗O2的量相等,两个反应也仅有O2作为氧化剂,故转移电子数是相等的,A项正确。①中H2O的H、O两元素的化合价没有变,故不作氧化剂,B项错;铜和钢构成原电池,腐蚀速度加快,C项错;钢铁是铁和碳的混合物,在潮湿的空气的中易发生吸氧腐蚀,属于电化学腐蚀,故D项错
[答案]A
例5. 如图所示,a、b、c、d均为石墨电极,通电进行电解。
|
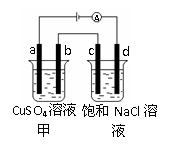
A.乙烧杯中d的电极反应为 2Cl––2e– Cl2↑
Cl2↑
B.a、c两极产生气体的物质的量相等
C.甲、乙两烧杯中溶液的pH均保持不变
|
 2NaOH + H2↑+ Cl2↑
2NaOH + H2↑+ Cl2↑
[解析]由图可以看出a、c均为阳极,分别生成O2、Cl2,所以生成的物质的量不相等;b、d均为阴极,所以d极发生的电极反应式为2H++2e-=H2↑;甲、乙两烧杯电解时的pH分别减小、增大。
[答案] D
例6. (09年安徽卷)Cu2O是一种半导体材料,基于绿色化学理念设计的制取.Cu2O的电解池示意图如下,点解总反应:2Cu+H2O==Cu2O+H2O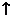 。下列说法正确的是
。下列说法正确的是
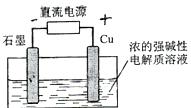 A.石墨电极上产生氢气
A.石墨电极上产生氢气
B.铜电极发生还原反应
C.铜电极接直流电源的负极
D.当有0.1mol电子转移时,有0.1molCu2O生成。
[解析]由电解总反应可知,Cu参加了反应,所以Cu作电解池的阳极,发生氧化反应,B选项错误;石墨作阴极,阴极上是溶液中的H+反应,电极反应为:2H++2e-=H2↑,A选项正确;阳极与电源的正极相连,C选项错误;阳极反应为2Cu+2OH--2e-=Cu2O+H2O,当有0.1mol电子转移时,有0.05molCu2O生成,D选项错误。
[答案]A.
例3、电子计算机所用钮扣电池的两极材料为锌和氧化银,电解质溶液为KOH溶液,其电极反应是: Zn + 2 OH- -2e=ZnO + H2O Ag2O +H2O + 2e=2Ag +2 OH-
下列判断正确的是
A.锌为正极,Ag2O为负极。
B.锌为负极,Ag2O为正极。
C.原电池工作时,负极区溶液PH减小。
D.原电池工作时,负极区溶液PH增大。
解析:本题考查原电池和PH的概念。原电池中失去电子的极为负极,所以锌为负极,Ag2O为正极。B是正确答案。因为 Zn + 2 OH- -2e=ZnO + H2O ,负极区域溶液中[OH-] 不断减少,故PH减小,所以C也正确。故选B、C。
答案:BC
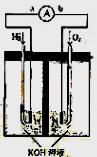 例4.氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:
例4.氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:
(1)氢氧燃料电池的能量转化主要形式是 ,在导线中电子流动方向为 (用a、b 表示)。
(2)负极反应式为 。
(3)电极表面镀铂粉的原因为 。
(4)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
Ⅰ.2Li+H2
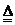 2LIH Ⅱ.LiH+H2O==LiOH+H2↑
2LIH Ⅱ.LiH+H2O==LiOH+H2↑
①反应Ⅰ中的还原剂是 ,反应Ⅱ中的氧化剂是 。
②已知LiH固体密度为0.82g/cm3。用锂吸收224L(标准状况)H2,生成的LiH体积与被吸收的H2体积比为 。
③由②生成的LiH与H2O作用,放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为 mol。
[解析]本题考查电化学知识。(1)原电池的实质为化学能转化成电能。总反应为2H2 + O2 =2H2O,其中H2从零价升至+1价,失去电子,即电子从a流向b。(2)负极为失去电子的一极,即H2失电子生成H+,由于溶液是碱性的,故电极反应式左右应各加上OH-。(3)铂粉的接触面积大,可以加快反应速率。(4)I.Li从零价升至+1价,作还原剂。II.H2O的H从+1降至H2中的零价,作氧化剂。由反应I,当吸收10molH2时,则生成20molLiH,V=m/ρ=20×7.9/0.82 ×10-3L=192.68×10-3L。V(LiH)/v(H2)= 192.68×10-3L/224L=8.71×10-4。20mol LiH可生成20mol H2,实际参加反应的H2为20×80%=1.6mol,1molH2转化成1molH2O,转移2mol电子,所以1.6molH2可转移3.2mol的电子
[答案]
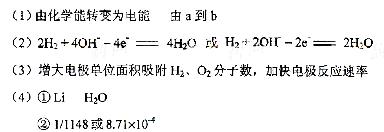
③32
例1.(09广东理科基础34)下列有关电池的说法不正确的是
A.手机上用的锂离子电池属于二次电池
B.铜锌原电池工作时,电子沿外电路从铜电极流向锌电极
C.甲醇燃料电池可把化学能转化为电能
D.锌锰干电池中,锌电极是负极
[解析]锂离子电池可以充用,再次使用,属于二次电池,A项正确;铜锌原电池中铜为正极,故电流为铜流向锌,而电子是由锌流向铜,B项错;电池的实质即是化学能转化成电能,C项正确;Zn失去电子生成Zn2+,故作为负极,D项正确
[答案]B
例2.下列叙述中正确的是
A.构成原电池正极和负极的材料必须是两种金属。
B.由铜、锌作电极与硫酸铜溶液组成的原电池中铜是负极。
C.马口铁(镀锡铁)破损时与电解质溶液接触锡先被腐蚀。
D.铜锌原电池工作时,若有13克锌被溶解,电路中就有0.4mol电子通过。
[解析] 两种活动性不同的金属与电解质溶液能够组成原电池,但不能因此说构成原电池电极的材料一定都是金属,例如锌和石墨电极也能跟电解质溶液组成原电池。在原电池中,活动金属中的电子流向不活动的电极,因此活动金属是负极。镀锡铁表皮破损后与电解质溶液组成原电池,铁较锡活泼,铁先失电子被腐蚀。铜锌原电池工作时,锌负极失电子,电极反应为Zn –2e==Zn2+,1molZn失去2mol电子,0.2mol锌(质量为13克)被溶解电路中有0.4mol电子通过。故选D
[答案]D
31.(2010·长沙一中第二次月考)下列各句中加点词语的使用,不恰当的一句是 ( )
A.新太空战略会使得美国在20年后操控全球能源市场,从而使得因碳氢燃料耗尽而陷入能源危机的全球子民们唯美国马首是瞻。
B.新发于硎的青年总会有一股振作奋发之气,在非常时期起用这群人,无疑能收到人尽其才,才尽其用的效果。
C.网络文学开路者痛惜当今的网络作者违背了始作俑者的初衷:本来是指向自由写作的梦想,现在却变成写手的逐利场与出版商的养鱼塘。
D.《霸王别姬》让梅兰芳的表演艺术登峰造极,那眉目间的神情、转身的华丽、水袖下的蕴藉,总是恰到好处,不瘟不火,将瞬间定格成永恒。
[解析] A.“从而”是连词,表示上文是原因、方法等,下文是结果、目的等。B.启用,开始使用,多用于事物。起用,重新任用已退职或免职官员;提拔使用。C.始作俑者:俑,古代殉葬用的木制或陶制的俑人。开始制作俑的人;比喻首先做某件坏事的人。原句并没有贬义意境,此处为误用。D.不瘟不火:指表演既不沉闷也不过火,对角色的把握恰如其分。褒义词。“瘟”指戏曲表演沉闷乏味。
[答案] C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com