
2.白磷与氧可发生如下反应:P4+5O2=P4O10。已知断裂下列化学键需要吸收的能量分别为:P-P akJ·mol-1、P-O bkJ·mol-1、P=O ckJ·mol-1、O=O dkJ·mol-1。
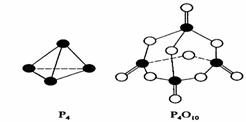
根据图示的分子结构和有关数据估算该反应的△H,其中正确的是 ( )
A.(6a+5d-4c-12b)kJ·mol-1 B(4c+12b-6a-5d)kJ·mol-1
C.(4c+12b-4a-5d)kJ·mol-1 D.(4a+5d-4c-12b)kJ·mol-1
|
化学键 |
Si-O |
Si-Cl |
H-H |
H-Cl |
Si-Si |
Si-C |
|
键能/kJ·mol-1 |
460 |
360 |
436 |
431 |
176 |
347 |
[例6]
则反应SiCl4(g)+2H2(g) Si(s)+4HCl(g)△H= kJ/mol
Si(s)+4HCl(g)△H= kJ/mol
[例7]炼铁时可能发生如下反应:
(1)Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H1 (2)3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) △H2
(3)Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H3 (4) FeO(s)+ CO(g)= Fe(s)+ CO2(g) △H4
则△H4与 △H1、△H2 △H3的关系是
[巩固练习]
1.下列关于热化学反应的描述中正确的是 ( )
A.反应是放热还是吸热必须看反应物和生成物所具有的总能量的相对大小。
B.CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)===2CO(g)+O2(g)反应的△H=2×283.0kJ/mol
C.需要加热才能发生的反应一定是吸热反应
D.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
定义:在101kp下, 物质完全燃烧生成 的氧化物时所放出的热量。
[说明]⑴燃烧热是以1mol物质完全燃烧所放出的热量来定义的,因此在书写燃烧热热化方程时,一般以燃烧1mol物质为标准来配平其余物质。
⑵燃烧产物必须是稳定的氧化物。例: :C-- ,H-- ,S-- ,N-- 。
[例4]已知标准状况下,1升H2S气体完全燃烧生成液态水时放出a kJ的热量,请写出硫化氢燃烧热的热化学方程式: 。
[例5]下列说法或表示法正确的是 ( )
A.等量的白磷蒸气和白磷固体分别完全燃烧,后者放出热量多
B.由C(石墨)→C(金刚石);ΔH = +1.19 kJ· mol-1可知,金刚石比石墨稳定
C.在稀溶液中:H+(aq)+OH-(aq)= H2O(l);ΔH=-57.3 kJ· mol-1,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ
D.在101 kPa时,2g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)= 2H2O(l);ΔH=-285.8 kJ· mol-1
有:△H1=△H2+△H3+△H4 应用:计算无法直接实验测量的反应的反应热。
[例3]已知下列反应的反应热为:
(1)CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) △H1=-870.3KJ/mol
(2)C(s)+O2(g)=CO2(g) △H2= -393.5KJ/mol
(3) H2(g)+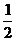 O2(g)=H2O(l) △H3= -285.8KJ/mol
O2(g)=H2O(l) △H3= -285.8KJ/mol
试计算下列反应的反应热: 2C(s)+2H2(g)+O2(g)=CH3COOH(l) △H=
2.热化学方程式的书写
注意点:①要注明物质状态:②ΔH数值与方程式中化学计量数有关:③ΔH=±x kJ/mol
[例1]下列热化学方程式书写正确的是( )
A、C(s)+O2(g)==CO2(g);△H=+393.5kJ/mol
B、2SO2+O2==2SO3;△H= -196.6kJ/mol
C、H2(g)+1/2O2(g)==H2O(l);△H= -285.8kJ/mol
D、2H2(g)+O2(g)==2H2O(l);△H= -571.6KJ
[例2]由氢气和氧气反应生成1mol水蒸气放热241.8kJ写出该反应的热化学方程式:
。若1g水蒸气转化为液态水放热2.44kJ,则反应H2(g)+1/2O2(g)=H2O(l)的△H= kJ/mol,氢气的燃烧热为 kJ/mol。
1.定义:表明反应所放出或吸收的热量的化学方程式,叫做热化学方程式。
2.规定:△H = - Q KJ/ mol < 0则为 反应;
△H = + Q KJ/ mol > 0则为 反应;
注意:在书写反应热△H的数值时,性质符号“+”或“-”不能省略。
1.定义:化学反应过程中吸收或放出的热量,叫做反应热。用 表示,单位为 。
4、能量变化的原因
⑴从化学键角度看(主要原因):
新键生成释放的能量 旧键断裂吸收的能量,则反应放热。
新键生成释放的能量 旧键断裂吸收的能量,则反应吸热。
⑵从物质本身能量看:
反应物总能量 生成物总能量,反应放热。
反应物总能量 生成物总能量,反应吸热。
3、常见放热反应:⑴燃烧反应 ⑵活泼金属+酸或水→H2 ⑶中和反应 ⑷CaO +H2O
⑸一般化合反应是放热反应。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com