
11.(08年广东理基·20)电池是人类生产和生活中重要的能量来源。各式各样电池的发明是化学对人类的一项重大贡献。下列有关电池的叙述正确的是
A.锌锰干电池工作一段时间后碳棒变细
B.氢氧燃料电池可将热能直接转变为电能
C.氢氧燃料电池工作时氢气在负极被氧化
D.太阳能电池的主要材料是高纯度的二氧化硅
答案:C
解析:A. 锌锰干电池的碳棒为负极,不会被消耗;
B. 燃料电池将燃料的化学能转化为电能和部分热能散失;
C. 燃料电池燃料是被氧化的,永远做负极;
D. 太阳能电池的主要材料是硅而非二氧化硅。
10.(08年广东化学·16)LiFePO4电池具有稳定性高、安全、对环境友好等优点,可用于电动汽车。电池反应为:FePO4+Li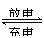
 LiFePO4,电池的正极材料是LiFePO4,负极材料是石墨,含Li+导电固体为电解质。下列有关LiFePO4电池说法正确的是
LiFePO4,电池的正极材料是LiFePO4,负极材料是石墨,含Li+导电固体为电解质。下列有关LiFePO4电池说法正确的是
A.可加入硫酸以提高电解质的导电性
B.放电时电池内部Li+向负极移动.
C.充电过程中,电池正极材料的质量减少
D.放电时电池正极反应为:FePO4+Li++e-=LiFePO4
答案:CD
解析:放电时,负极:Li -- e- ==Li+,正极:FePO4 + Li+ + e- == LiFePO4;充电时,阳极:LiFePO4 -- e- == FePO4 + Li+ 阴极:Li+ + e- == Li,所以易知C.D正确。
若加入硫酸,与Li单质(固体)发生反应,所以A错;放电时,Li+应(正电荷)在电池内部(电解质中)向正极移动,故B错。
9.(08年广东化学·12)下列有关金属腐蚀与防护的说法正确的是
A.纯银器表面在空气中因化学腐蚀渐渐变暗
B.当镀锡铁制品的镀层破损时,镶层仍能对铁制品起保护作用
C.在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法
D.可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀
答案:AC
解析:银器在空气中久置会被O2所氧化变黑,为化学腐蚀,A正确。当镀层破损时,Sn-Fe可形成原电池,不再起到保护作用,B错。与Zn块形成原电池,Zn作负极(阳极),从而保护Fe正极(阴极),所以C正确;外加电流保护法应该与直流电源的负极相连,故D错。
8.(08年广东化学·5)用铜片、银片、Cu (NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U型管)构成一个原电池。以下有关该原电池的叙述正确的是C
①在外电路中,电流由铜电极流向银电极 ②正极反应为:Ag++e-=Ag
③实验过程中取出盐桥,原电池仍继续工作
④将铜片浸入AgNO3溶液中发生的化学反应与该原电池反应相同
A.①② B.②③ C.②④ D.③④
答案:C
解析:Cu作负极,Ag作正极。负极:Cu-2e-==Cu2+;正极:A+ + e- ==Ag。
在外电路中,电子由Cu电极流向Ag电极,而电流方向与电子流向相反,所以1错。没有盐桥,原电池不能继续工作,3错。无论是否为原电池,反应实质相同,均为氧化还原反应,4对。
7.(08年广东化学·2)海水是一个巨大的化学资源库,下列有关海水综合利用的说法正确的是C
A.海水中含有钾元素,只需经过物理变化就可以得到钾单质
B.海水蒸发制海盐的过程中只发生了化学变化
C.从海水中可以得到NaCl,电解熔融NaCl可制备Cl2
D.利用潮汐发电是将化学能转化为电能
答案:C
解析:海水中钾元素以K+形式存在,生成钾单质必然发生化学反应,A错。蒸发制海盐发生的是物理变化,B错。潮汐发电是将动能转化为电能,D错。
6.(08年宁夏理综·10)一种燃料电池中发生的化学反应为:在酸性溶液中甲醇与氧作用生成水和二氧化碳。该电池负极发生的反应是
A.CH3OH(g)+O2(g)=H2O(1)+CO2(g)+2H+(aq)+2e-
B.O2(g)+4H+(aq)+4e-=2H2O(1)
C.CH3OH(g)+H2O(1)=CO2(g)+6H+(aq)+6e-
D.O2(g)+2H2O(1)+4e-=4OH-
答案:C
解析:甲醇与氧气反应的化学方程式为:2CH3OH+3O2 2CO2+4H2O,化合价升高的元素为C,所以在负极上甲醇失去电子而放电,在该极上的电极反应式为:CH3OH(g)+H2O(1)=CO2(g)+6H+(aq)+6e-。
2CO2+4H2O,化合价升高的元素为C,所以在负极上甲醇失去电子而放电,在该极上的电极反应式为:CH3OH(g)+H2O(1)=CO2(g)+6H+(aq)+6e-。
5.(07年广东化学·20)三氧化二镍(Ni2O3)可用于制造高能电池,其电解法制备过程如下:用NaOH调NiCl2溶液pH至7.5,加入适量硫酸钠后进行电解。电解过程中产生的Cl2在弱碱性条件下生成ClO-,把二价镍氧化为三价镍。以下说法正确的是
A.可用铁作阳极材料
B.电解过程中阳极附近溶液的pH升高
C.阳极反应方程式为:2Cl--2e-=Cl2
D.1mol二价镍全部转化为三价镍时,外电路中通过了1mol电子。
答案:CD
解析:电解时阳极产生Cl2,电极反应为2Cl--2e-=Cl2,,故C对,阳极不可能是活泼性电极如铁,故A错。阳极产生Cl2与碱反应,故pH值降低,故B错,二价镍全部转化为三价镍失e-,故D对。
4.(07年广东理基·25)钢铁在潮湿的空气中会被腐蚀,发生的原电池反应为:2Fe+2H2O+O2 2Fe2++4OH-。以下说法正确的是
A.负极发生的反应为:Fe-2e- Fe2+
B.正极发生的反应为:2H2O+O2+2e- 4OH-
C.原电池是将电能转变为化学能的装置
D.钢柱在水下部分比在空气与水交界处更容易腐蚀
答案:A
解析:钢铁在潮湿的环境中发生吸氧腐蚀,负极反应为:Fe-2e- Fe2+,正极反应为:2H2O+O2+4e- 4OH-,在空气与水交界处溶液中的氧气不断溶解,因此在空气与水交界处钢铁更容易腐蚀。
3.(07年广东文基·62)下列说法正确的是
A.需要加热的化学反应都是吸热反应
B.中和反应都是放热反应
C.原电池是将电能转化为化学能的一种装置
D.水力发电是将化学能转化为电能的过程
答案:B
解析:需要加热的化学反应也可能是放热反应,如可燃物的燃烧反应,A选项错误;原电池是将化学能转化为电能的装置,故C选项错误;水力发电是将机械能转化为电能的过程,故D选项错误。正确选项为B
2.(07年广东化学·12)为了避免青铜器生成铜绿,以下方法正确的是
A.将青铜器放在银质托盘上
B.将青铜器保存在干燥的环境中
C.将青铜器保存在潮湿的空气中
D.在青铜器的表面覆盖一层防渗的高分子膜
答案:BD
解析:铜绿是生活中常见现象,反应原理为2Cu+O2+CO2+H2O==Cu2CO3(OH)2,故青铜器应保存在干燥的环境中或表面覆盖一层防渗的高分子膜防止被腐蚀。A可能发生原电池反应而被腐蚀。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com