
24.(09年广东文基·68)下列说法正确的是
A.废旧电池应集中回收,并填埋处理
B.充电电池放电时,电能转变为化学能
C.放在冰箱中的食品保质期较长,这与温度对反应速率的影响有关
D.所有燃烧反应都是放热反应,所以不需吸收能量就可以进行
答案:C
解析:A项废旧电池应集中回收但不能填埋处理因为电池里的重金属会污染土地,人吃了这些土地里的蔬菜后,,就会引发疾病;B项充电电池放电时,化学能转变为电能;D项有的燃烧反应是需要吸收一定热量才可以反应的比如碳的燃烧。
21.(09年广东理基·34)下列有关电池的说法不正确的是
A.手机上用的锂离子电池属于二次电池
B.铜锌原电池工作时,电子沿外电路从铜电极流向锌电极
C.甲醇燃料电池可把化学能转化为电能
D.锌锰干电池中,锌电极是负极
答案:B
解析:手机上用的锂离子电池可以反复充放电,属于二次电池,A选项正确。锌比铜活泼,因此构成原电池时,锌失电子做负极,电子眼外电路流向正极铜,所以B选项错误。
22 .(09年江苏化学·5)化学在生产和日常生活中有着重要的应用。下列说法不正确的是
.(09年江苏化学·5)化学在生产和日常生活中有着重要的应用。下列说法不正确的是
 A.明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化
A.明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化
 B.在海轮外壳上镶入锌块,可减缓船体的腐蚀速率
B.在海轮外壳上镶入锌块,可减缓船体的腐蚀速率
 C.MgO的熔点很高,可用于制作耐高温材料
C.MgO的熔点很高,可用于制作耐高温材料
 D.电解MgCl2饱和溶液,可制得金属镁
D.电解MgCl2饱和溶液,可制得金属镁
 答案:D
答案:D
 解析:A项,明矾净水的原理是Al3++3H2O
解析:A项,明矾净水的原理是Al3++3H2O Al(OH)3(胶体)+3H+,利用Al(OH)3(胶体)的吸附性进行净水;B项,是因为轮船主要用铁造外壳,铁在海水中易被腐蚀.镀上比铁活泼的锌,形成原电池,锌作负极,失去电子先被腐蚀,从而起到保护铁的作用,从而可减缓船体的腐蚀速率;氧化镁的熔点是2852℃,可用于制作耐高温材料;电解MgCl2饱和溶液,发生地化学反应为MgCl2+2H2O
Al(OH)3(胶体)+3H+,利用Al(OH)3(胶体)的吸附性进行净水;B项,是因为轮船主要用铁造外壳,铁在海水中易被腐蚀.镀上比铁活泼的锌,形成原电池,锌作负极,失去电子先被腐蚀,从而起到保护铁的作用,从而可减缓船体的腐蚀速率;氧化镁的熔点是2852℃,可用于制作耐高温材料;电解MgCl2饱和溶液,发生地化学反应为MgCl2+2H2O Mg(OH)2+Cl2↑+H2↑,不会产生金属镁,电解熔融的MgCl2能制取单质镁,发生的反应MgCl2(熔融)
Mg(OH)2+Cl2↑+H2↑,不会产生金属镁,电解熔融的MgCl2能制取单质镁,发生的反应MgCl2(熔融) Mg+Cl2↑。
Mg+Cl2↑。
 [考点分析](1)物质的水解反应,以及水解反应的用途;(2)常见生活常识的原理;(3)常见物质在生产生活中的具体用途;(4)常见物质的制备及发生的化学反应方程式。
[考点分析](1)物质的水解反应,以及水解反应的用途;(2)常见生活常识的原理;(3)常见物质在生产生活中的具体用途;(4)常见物质的制备及发生的化学反应方程式。
 23
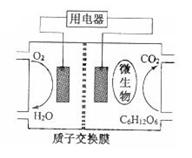
23 .(09年江苏化学·12)以葡萄糖为燃料的微生物燃料电池结构示意图如图所示。关于该电池的叙述正确的是
.(09年江苏化学·12)以葡萄糖为燃料的微生物燃料电池结构示意图如图所示。关于该电池的叙述正确的是
 A.该电池能够在高温下工作
A.该电池能够在高温下工作
 B.电池的负极反应为:C6H12O6+6H2O-24e-
B.电池的负极反应为:C6H12O6+6H2O-24e- 6CO2↑+24H+
6CO2↑+24H+

 C.放电过程中,H+从正极区向负极区迁移
C.放电过程中,H+从正极区向负极区迁移
 D.在电池反应中,每消耗1mol氧气,理论上能生成标准状况下CO2气体
D.在电池反应中,每消耗1mol氧气,理论上能生成标准状况下CO2气体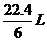
 答案:B
答案:B
 解析:A项,高温条件下微生物会变性,所以A错;B项,负极是葡萄糖失电子生成二氧化碳,所以B对;C项,原电池内部阳离子应向正极移动,所以C错;D项,消耗1mol氧气生成1mol二氧化碳,标准状况下体积是22.4L,D错。
解析:A项,高温条件下微生物会变性,所以A错;B项,负极是葡萄糖失电子生成二氧化碳,所以B对;C项,原电池内部阳离子应向正极移动,所以C错;D项,消耗1mol氧气生成1mol二氧化碳,标准状况下体积是22.4L,D错。
20.(09年广东理基·25)钢铁生锈过程发生如下反应:
①2Fe+O2+2H2O=2Fe(OH)2;
②4Fe(OH)2+O2+2H2O=4Fe(OH)3;
③2Fe(OH)3=Fe2O3+3H2O。
下列说法正确的是
A.反应①、②中电子转移数目相等
B.反应①中氧化剂是氧气和水
C.与铜质水龙头连接处的钢质水管不易发生腐蚀
D.钢铁在潮湿的空气中不能发生电化学腐蚀
答案:A
解析:反应①2Fe+O2+2H2O=2Fe(OH)2中的氧化剂是O2,1molO2在反应中得到4mol电子,同样在反应②4Fe(OH)2+O2+2H2O=4Fe(OH)3中氧化剂也是O2,而且两个反应中氧气的系数都是1,因此得到的电子均是4mol,故A选项正确B选项错误。钢质水管与铜质水龙头连接后形成原电池,其中钢质水管做负极被腐蚀,故C选项错误。钢铁在潮湿的空气中容易发生电化学腐蚀,而且主要是发生吸氧腐蚀,因此D选项错误。
19.(09年广东化学·14)可用于电动汽车的铝-空气燃料电池,通常以NaCl溶液或NaOH溶液为点解液,铝合金为负极,空气电极为正极。下列说法正确的是
A.以NaCl溶液或NaOH溶液为电解液时,正极反应都为:O2+2H2O+4e-=4OH-
B.以NaOH溶液为电解液时,负极反应为:Al+3OH--3e=Al(OH)3↓
C.以NaOH溶液为电解液时,电池在工作过程中电解液的pH保持不变
D.电池工作时,电子通过外电路从正极流向负极
答案:A
解析:无论是NaOH还是NaCl,在正极上都是O2得到电子被还原,A正确;生成的Al(OH)3是两性氢氧化物,在碱溶液中发生反应生成AlO2-,B错误;生成的Al(OH)3与NaOH反应生成NaAlO2,消耗电解质中的NaOH,使pH减少,C错误;原电池中,电子在外电路的负极流向正极,D错误。
18.(09年广东化学·10)出土的锡青铜(铜锡合金)文物常有Cu2(OH)3Cl覆盖在其表面。下列说法正确的是
A.锡青铜的熔点比纯铜高
B.在自然环境中,锡青铜中的锡对铜起保护作用
C.锡青铜文物在潮湿环境中的腐蚀比干燥环境中快
D.生成Cu2(OH)3Cl覆盖物是电化学腐蚀过程,但不是化学反应过程
答案:BC
解析:合金的熔点一般比各组分的熔点要低,所以锡铜合金的熔点比纯铜低,A错误;Sn与Cu形成原电池,因Sn比Cu金属活泼性强,所以 Sn作负极,Cu作正极,Sn对Cu起到保护作用,B正确;合金在潮湿环境下,可可以发生电化学腐蚀,比干燥环境腐蚀要快,C正确;电化学腐蚀同样属于化学反应过程,D错误。
17.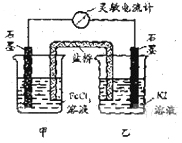
 (09年福建理综·11)控制适合的条件,将反应2Fe3++2I-
(09年福建理综·11)控制适合的条件,将反应2Fe3++2I- 2Fe2++I2设计成如右图所示的原电池。下列判断不正确的是
2Fe2++I2设计成如右图所示的原电池。下列判断不正确的是
 A.反应开始时,乙中石墨电极上发生氧化反应
A.反应开始时,乙中石墨电极上发生氧化反应
 B.反应开始时,甲中石墨电极上Fe3+被还原
B.反应开始时,甲中石墨电极上Fe3+被还原
 C.电流计读数为零时,反应达到化学平衡状态
C.电流计读数为零时,反应达到化学平衡状态
 D.电流计读数为零后,在甲中溶入FeCl2固定,乙中石墨电极为负极
D.电流计读数为零后,在甲中溶入FeCl2固定,乙中石墨电极为负极
答案:D
解析:乙中I-失去电子放电,故为氧化反应,A项正确;由总反应方程式知,Fe3+被还原成Fe2+,B项正确;当电流计为零时,即说明没有电子发生转移,可证明反应达平衡,C项正确。加入Fe2+,导致平衡逆向移动,则Fe2+失去电子生成Fe3+,而作为负极,D项错。
15.(08年山东理综·9)下列叙述合理的是D
A.金属材料都是导体,非金属材料都是绝缘体
B.棉、麻、丝、毛及合成纤维完全燃烧都只生成CO2和H2O
C.水电站把机械能转化为电能,而核电站把化学能转化成电能
D.我国规定自2008年6月1日起,商家不得无偿提供塑料袋,目的是减少“白色污染”
答案:D
解析:选项A中非金属材料如石墨是导体,Si等为半导体;选项B中丝、毛的主要成分为蛋白质,其燃烧产物除CO2和H2O外,还有氮的化合物等,合成纤维的组成除C、H元素外,还含有其它元素,所以燃烧的产物除CO2和H2O外,还可能含有其它物质;选项C中水电站是把水能转化为电能;核电能是把原子核的能量转化为电能。
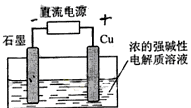 16
16 .(09年安徽理综·12)Cu2O是一种半导体材料,基于绿色化学理念设计的制取.Cu2O的电解池示意图如下,点解总反应:2Cu+H2O==Cu2O+H2O↑。下列说法正确的是
.(09年安徽理综·12)Cu2O是一种半导体材料,基于绿色化学理念设计的制取.Cu2O的电解池示意图如下,点解总反应:2Cu+H2O==Cu2O+H2O↑。下列说法正确的是
 A.石墨电极上产生氢气
A.石墨电极上产生氢气
 B.铜电极发生还原反应
B.铜电极发生还原反应
 C.铜电极接直流电源的负极
C.铜电极接直流电源的负极
 D.当有0.1mol电子转移时,有0.1molCu2O生成。
D.当有0.1mol电子转移时,有0.1molCu2O生成。
 答案:A
答案:A
 解析:由电解总反应可知,Cu参加了反应,所以Cu作电解池的阳极,发生氧化反应,B选项错误;石墨作阴极,阴极上是溶液中的H+反应,电极反应为:2H++2e-=H2↑,A选项正确;阳极与电源的正极相连,C选项错误;阳极反应为2Cu+2OH--2e-=Cu2O+H2O,当有0.1mol电子转移时,有0.05molCu2O生成,D选项错误。
解析:由电解总反应可知,Cu参加了反应,所以Cu作电解池的阳极,发生氧化反应,B选项错误;石墨作阴极,阴极上是溶液中的H+反应,电极反应为:2H++2e-=H2↑,A选项正确;阳极与电源的正极相连,C选项错误;阳极反应为2Cu+2OH--2e-=Cu2O+H2O,当有0.1mol电子转移时,有0.05molCu2O生成,D选项错误。
14.(08年江苏化学·6)下列装置或操作能达到实验目的的是
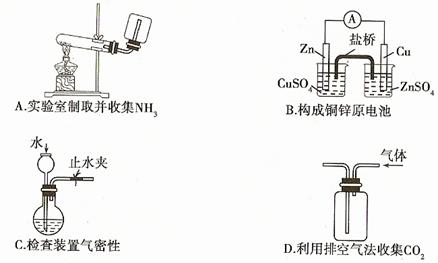
答案:C
解析:A中收集氨气装置无棉花,(棉花的目的是防止气体对流,在计短的时间内收集满氨气);B中右边烧杯中电解质溶液应收硫酸铜,C是实验中常见检查气密性的装置,C对;收集比空气重的气体应该是长进短出故D错。
13.(08年江苏化学·5)镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd + 2NiOOH + 2H2O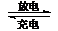 Cd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是
Cd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是
A.充电时阳极反应:Ni(OH)2 -e- + OH- == NiOOH + H2O
B.充电过程是化学能转化为电能的过程
C.放电时负极附近溶液的碱性不变
D.放电时电解质溶液中的OH-向正极移动
答案:A
解析:由充电时方程式中的Cd和Ni的化合价的变化可知,Ni(OH)2作阳极,电解质溶液为KOH,所以电极反应式为:Ni(OH)2-e- +OH-===NiOOH+H2O;Cd(OH)2作阴极,Cd(OH)2+2e- ===Cd+2OH-;充电的过程是将电能转化为化学能,放电时,Cd作负极,Cd-2e-+2OH- ===Cd(OH)2,Cd周围的c(OH-)下降,OH-向负极移动。
12.(08年海南化学·7)关于铅蓄电池的说法正确的是
A.在放电时,正极发生的反应是 Pb(s) +SO42-(aq)= PbSO4(s) +2e-
B.在放电时,该电池的负极材料是铅板
C.在充电时,电池中硫酸的浓度不断变小
D.在充电时,阳极发生的反应是 PbSO4(s)+2e-= Pb(s)+ SO42-(aq)
答案:B
解析:铅蓄电池的充放电反应为:Pb+PbO2+2H2SO4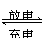
 PbSO4+2H2O,放电时Pb作负极:Pb-2e-+SO42- ===PbSO4,在正极上:PbO2+2e-+4H++SO42- ===PbSO4+2H2O;充电时,H2SO4的浓度不断增大,阳极上发生的是氧化反应,是失去电子而不是得到电子。
PbSO4+2H2O,放电时Pb作负极:Pb-2e-+SO42- ===PbSO4,在正极上:PbO2+2e-+4H++SO42- ===PbSO4+2H2O;充电时,H2SO4的浓度不断增大,阳极上发生的是氧化反应,是失去电子而不是得到电子。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com