
1.根据实验中所给仪器选用试剂
若选用U形干燥管或球形干燥管,则要选用_____ _(填物质的状态)干燥剂;若选用洗气瓶,则要选用____ ___干燥剂;若选用启普发生器或其简易装置制取气体,则选用固体必须________________,而不能选用___ __________。
4.对瓶塞的要求
_____________________由于能和玻璃中的SiO2 反应而使瓶口和瓶塞粘在一起不易打开,所以盛放___________的试剂瓶常用________________________。_____________。
__________________等能腐蚀橡皮,__________能对橡皮产生溶胀作用,因此,盛放这些试剂的试剂瓶都要用_____________。
3.对试剂瓶的一般要求
固体药品保存在________中,以便用___________取用,液体药品保存在____________中;_________________等见光易分解的试剂要保存在________中。
2. 特殊保存的几种试剂
|
类别 |
常见药品 |
有关特性 |
保存方法 |
|
见光易 变质 |
氯水、硝酸、AgNO3、双氧水 |
见光易分解、有强氧化性 |
棕色瓶中,冷暗处,不用橡皮塞 |
|
易燃 |
⑴ 红磷、硫、镁 |
遇火易燃 |
远离火种,单独存放 |
|
⑵ 汽油、苯、乙醇、低级酯 |
易燃有机溶剂 |
远离火种,不用橡皮塞 |
|
|
易爆 |
⑴ KMnO4、KClO3、NH4NO3、KNO3 |
受热易分解,强氧化性 |
远离易燃物,防受热撞击 |
|
⑵ 硝酸纤维、银氨溶液 |
不稳定、易引起爆炸 |
随用随制 |
|
|
强 腐 蚀 性 |
⑴ 液溴 |
易挥发的强氧化剂 |
棕色瓶中,玻璃塞,水封 |
|
⑵ 氢氟酸 |
腐蚀玻璃 |
塑料瓶中 |
|
|
剧毒 |
P4、Hg、HgCl2、可溶钡盐、KCN |
对人和生物有剧毒 |
单独存放、专人管理 |
化学试剂的保存一般要根据物质本身的性质和可能变质的原因,选用不同的保存方法,以保证药品完好无损,同时不影响周围环境。
1.需密封保存的试剂
⑴由于试剂与空气中的某种成分作用而要密封保存
①能与CO2作用的:碱类如_______________________等,含比碳酸更弱的酸的盐如______________________等,另外还有碱石灰、过氧化钠等等。
②能与水作用的:与水反应的单质有____________________等,与水反应的氧化物有____________________________等,与水反应的盐有________________________等;易潮解的物质有______________________________________________等;易吸水的液态物质有 _______________________。
③能与O2反应的:还原性较强的物质常温下一般都易与O2反应,如______________等单质,____________等盐, 等有机物。
⑵由于试剂易挥发应密封保存,如______________等无机试剂以及____________等有机溶剂,这些物质除了密封外,还要注意置于阴凉处。
5.还原法:C+H2O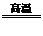 CO+H2,Zn+2HCl=ZnCl2+H2↑ 2C+ SiO2
CO+H2,Zn+2HCl=ZnCl2+H2↑ 2C+ SiO2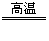 Si+2CO↑
Si+2CO↑
试题枚举
[例1] (1)氰化钾、氰化氢的制备反应式为:K2CO3+C+2NH3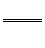 2KCN+3H2O;△H=+276kJ/mol ①
2KCN+3H2O;△H=+276kJ/mol ①
CO+NH3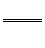 HCN+H2O;△H=+46kJ/mol ②
HCN+H2O;△H=+46kJ/mol ②
氰离子为负一价(CN-),其中碳氮元素的化合价分别为________。 以上两个反应是否均为氧化还原反应?(2)制备纯净无水HCN(沸点299K)的另一种方法是 :混合磨细的KCN和KHS粉末适度加热①试写出这个反应式。②为什么要磨细和用粉末?③为什么要强调适度加热?
解析:据共价键理论,一般当碳同非金属性比它强的元素结合时,碳显正价,氮为负价,为-3价,所以(CN-)中碳为+2价,氮为-3价。故①为氧化还原反应,②为非氧化 还原反应。第二种方法制备HCN是固体与固体之间的反应,故磨细和用粉末的目的是增大表面积,加快反应速率,据题意知,第二种方法制备HCN如温度太低,反应速率较小,温度太高,则酸式盐易分解发生副反应:2KHS
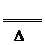 K2S+H2S↑。该反应的化学方程式为KCN+KHS
K2S+H2S↑。该反应的化学方程式为KCN+KHS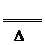 HCN↑+K2S。
HCN↑+K2S。
[例2] 金属M可以在不同条件下发生下列五个反应:M+A→I M+B→H M+C→H+F M+D→H+A M+E→I+G 其中(1)A、B、C、D、E在通常情况下都是气体,并且C是CO 2。(2)上述反应的产物,在不同条件下,还可和有关反应物发生下列反应:F+B→C A +G→E,(3)I是一种离子化合物,它可以水解产生一种白色沉淀和E。该白色沉淀加热可 分解为H和H2O。而E则是分子晶体,其分子中共有10个电子,根据以上条件,判断并写出 有关物质的化学式:A________,B________,C________,D________,E________,F________,G________,H________,I________,M________。
解析: 本题的突破口是M+C→H+F,而C为CO2。一般同CO2能发生反应的金属就现有知识来讲,只能是Mg。F、H中有一为碳,根据F+B→C,则C为CO2,B为气体,F肯定为碳,H为MgO。扫描全题,得知E是分子晶体,且其分子中共有10个电子。分子中有10个电子的有:HF、H2O、NH3、CH4等。而E又通过一种离子化合物水解而得到,E可能为 HF或NH3。如E为HF,根据M+E→I+G,HF同Mg作用,但事实HF同Mg不反应。如为NH3同样根据A+G→E,A为N2或H2。因为Mg可跟A作用,显然A为N2,I为Mg3N2。再根据M+D→H+A,M为Mg,H为MgO,A为N2,则D只能为NO2。
答案:A:N2,B:O2,C:CO2,D:NO2,E:NH3,F:C,G:H2,H:MgO,I:Mg 3N2,M:Mg。
4.氧化法:如MnO2+4HCl(浓)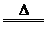 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
4NaBr+3H2SO4+MnO2=2Na2SO4+MnSO4+2Br2+3H2O
2H2S+SO2=3S+2H2O
3.置换法:如Cl2+2NaBr=2NaCl+Br2 2H2S+O2(不足) 2H2O+2S
2H2O+2S
2.分解法:如2KClO3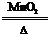 2KCl+3O2↑ CH4
2KCl+3O2↑ CH4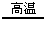 C+2H2 2H2O2
C+2H2 2H2O2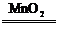 2H2O+O2↑
2H2O+O2↑
1.电解法
①电解水溶液:如2NaCl+2H2O 2NaOH+Cl2↑+H2↑
2NaOH+Cl2↑+H2↑
②电解熔融物:如2KHF2 F2↑+H2↑+2KF
F2↑+H2↑+2KF
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com