
5.现有5根竹竿,它们的长度(单位:m)分别为2.5,2.6,2.7,2.8,2.9,若从中一次随机抽取2根竹竿,则它们的长度恰好相差0.3m的概率为 ▲ .
[解析] 考查等可能事件的概率知识。
从5根竹竿中一次随机抽取2根的可能的事件总数为10,它们的长度恰好相差0.3m的事件数为2,分别是:2.5和2.8,2.6和2.9,所求概率为0.2。
4. 函数
函数 (
( 为常数,
为常数, )在闭区间
)在闭区间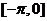 上的图象如图所示,则
上的图象如图所示,则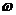 = ▲ .
= ▲ .
[解析] 考查三角函数的周期知识。
 ,
, ,所以
,所以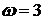 ,
,
3.函数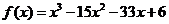 的单调减区间为 ▲ .
的单调减区间为 ▲ .
[解析] 考查利用导数判断函数的单调性。
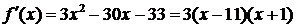 ,
,
由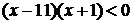 得单调减区间为
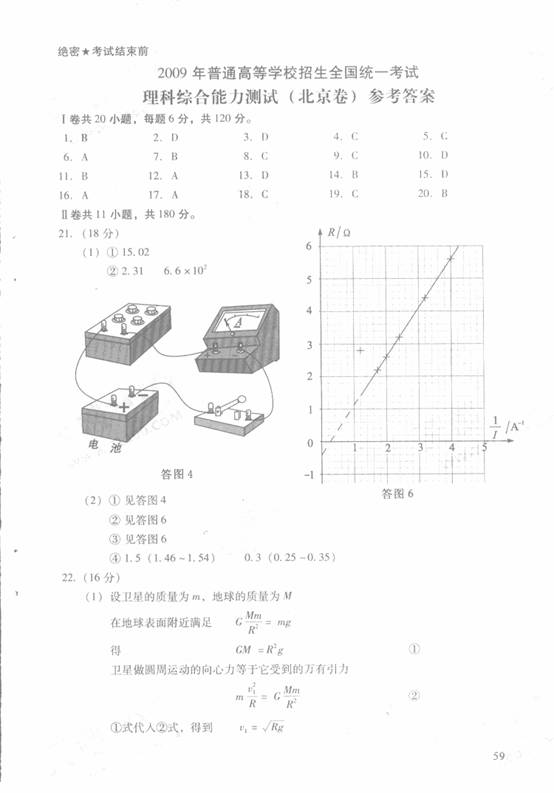
得单调减区间为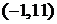 。亦可填写闭区间或半开半闭区间。
。亦可填写闭区间或半开半闭区间。
2.已知向量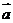 和向量
和向量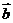 的夹角为
的夹角为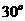 ,
,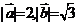 ,则向量
,则向量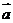 和向量
和向量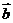 的数量积
的数量积 = ▲。
= ▲。
[解析] 考查数量积的运算。 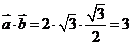
1.若复数 其中
其中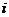 是虚数单位,则复数
是虚数单位,则复数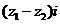 的实部为 ▲ 。
的实部为 ▲ 。
[解析]考查复数的减法、乘法运算,以及实部的概念。 -20
31.(14分)
某人在持续几天咳嗽后发热,经诊断是细菌感染引发了肺炎。用药后得以康复。请回答问题:
(1)侵入人体的细菌是一种发热激活物,通过一系列反应引起人体发热。体温过高时,人体新陈代谢加快,细胞内葡萄糖氧化分解 ,耗氧量 ;由于供氧不足,肌肉组织中 含量增高,病人会感觉肌肉酸痛。
(2)人的体温是由位于 的 中枢调控的。
(3)发热到体温恢复正常的过程中,人体的 和 系统参与了调节,最终实现稳态。



30.(16分)
为研究森林群落在生态系统物质循环中的作用,美国一研究小组在某无人居住的落叶林区进行了3年实验。实验区是两个毗邻的山谷(编号1、2),两个山谷各有一条小溪。1965年冬,研究人员将2号山谷中的树木全部砍倒留在原地。通过连续测定两条小溪下游的出水量和硝酸盐含量,发现2号山谷小溪出水量比树木砍倒前升高近40%。两条小溪中的硝酸盐含量变化如图所示。

请回答问题:
(1) 大气中的N2进入该森林群落的两种途径有 。在森林群落中,能从环境中直接吸收含氮无机物的两大类生物是 。
(2) 氮元素以N2、NO3-和 的形式被生物吸收,进入细胞后主要用于合成 两类生物大分子。
(3) 图中显示,1号山谷溪水中的硝酸盐含量出现季节性规律变化,其原因是不同季节生物 。
(4) 1966年5月后,2号山谷溪水中的硝酸盐含量急剧升高,主要的两个原因是 。
(5) 硝酸盐含量过高的水不宜饮用。在人体消化道中,硝酸盐可转变成亚硝酸盐。NO2-能使DNA中C-G碱基对中的“C”脱氨成为“U”。上述发生突变的碱基对经两次复制后,在该位点上产生的碱基对新类型是 、 。
(6) 氮元素从森林群落输出的两种途径是 。
(7) 该实验结果说明森林群落中植被的两个主要作用是 。
29.(18分)
鸭蛋蛋壳的颜色主要有青色和白色两种。金定鸭产青色蛋,康贝尔鸭产白色蛋。为研究蛋壳颜色的遗传规律,研究者利用这两个鸭群做了五组实验,结果如下表所示。
|
杂交组合 |
第1组 |
第2组 |
第3组 |
第4组 |
第5组 |
|
|
康贝尔鸭♀×金定鸭♂ |
金定鸭♀×康贝尔鸭♂ |
第1组的F1自交 |
第2组的F1自交 |
第2组的F1♀×康贝尔鸭♂ |
||
|
后代所产蛋(颜色及数目) |
青色(枚) |
26178 |
7628 |
2940 |
2730 |
1754 |
|
白色(枚) |
109 |
58 |
1050 |
918 |
1648 |
请回答问题:
(1)根据第1、2、3、4组的实验结果可判断鸭蛋壳的 色是显性性状。
(2)第3、4组的后代均表现出 现象,比例都接近 。
(3)第5组实验结果显示后代产青色蛋的概率接近 ,该杂交称为 ,用于检验 。
(4)第1、2组的少数后代产白色蛋,说明双亲中的 鸭群混有杂合子。
(5)运用 方法对上述遗传现象进行分析,可判断鸭蛋壳颜色的遗传符合孟德尔的 定律。
28. (15分)
以黄铁矿为原料生产硫酸的工艺流程图如下:
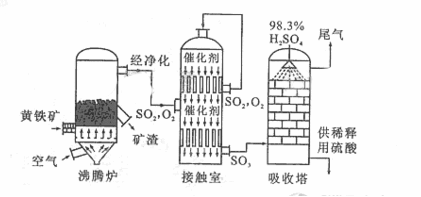
(1)将燃烧黄铁矿的化学方程式补充完整
4 +11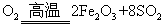
(2)接触室中发生反应的化学方程式是 。
(3)依据工艺流程图判断下列说法正确的是(选填序号字母) 。
a. 为使黄铁矿充分燃烧,需将其粉碎
b. 过量空气能提高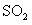 的转化率
的转化率
c. 使用催化剂能提高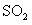 的反应速率和转化率
的反应速率和转化率
d. 沸腾炉排出的矿渣可供炼铁
(4)每160g 气体与
气体与 化合放出260.6kJ的热量,该反应的热化学方程是 。
化合放出260.6kJ的热量,该反应的热化学方程是 。
(5)吸收塔排出的尾气先用氨水吸收,再用浓硫酸处理,得到较高浓度的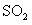 和铵盐。
和铵盐。
①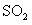 既可作为生产硫酸的原料循环再利用,也可用于工业制溴过程中吸收潮湿空气中的
既可作为生产硫酸的原料循环再利用,也可用于工业制溴过程中吸收潮湿空气中的 。
。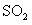 吸收
吸收 的离子方程式是
。
的离子方程式是
。
② 为测定该铵盐中氮元素的质量分数,将不同质量的铵盐分别加入到50.00mL相同浓度的 溶液中,沸水浴加热至气体全部逸出(此温度下铵盐不分解)。该气体经干燥后用浓硫酸吸收完全,测定浓硫酸增加的质量。
溶液中,沸水浴加热至气体全部逸出(此温度下铵盐不分解)。该气体经干燥后用浓硫酸吸收完全,测定浓硫酸增加的质量。
部分测定结果;
铵盐质量为10.00g和20.00g 时,浓硫酸增加的质量相同;铵盐质量为30.00g时,浓硫酸增加的质量为0.68g;铵盐质量为40.00g时,浓硫酸的质量不变。
计算:该铵盐中氮元素的质量分数是 %; 若铵盐质量为15.00g。 浓硫酸增加的质量为 。 (计算结果保留两位小数)
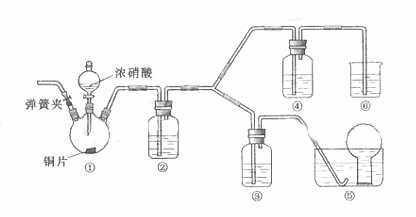
27.(14分)
某学习小组探究浓、稀硝酸氧化性的相对强弱的,按下图装置进行试验(夹持仪器已略去)。实验表明浓硝酸能将 氧化成
氧化成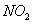 ,而稀硝酸不能氧化
,而稀硝酸不能氧化 。由此得出的结论是浓硝酸的氧化性强于稀硝酸。
。由此得出的结论是浓硝酸的氧化性强于稀硝酸。
可选药品:浓硝酸、3mo/L稀硝酸、蒸馏水、浓硫酸、氢氧化钠溶液及二氧化碳
已知:氢氧化钠溶液不与 反应,能与
反应,能与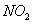 反应
反应
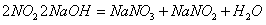
(1) 实验应避免有害气体排放到空气中,装置③、④、⑥中乘放的药品依次是
(2) 滴加浓硝酸之前的操作时检验装置的气密性,加入药品,打开弹簧夹后
(3) 装置①中发生反应的化学方程式是
(4) 装置②的作用是 ,发生反应的化学方程式是
(5) 该小组得出的结论一局的试验现象是
(6) 试验结束后,同学们发现装置①中溶液呈绿色,而不显蓝色。甲同学认为是该溶液中硝酸铜的质量分数较高所致,而乙同学认为是该溶液中溶解了生成的气体。同学们分别涉及了一下4个试验来判断两种看法是否正确。这些方案中可行的是(选填序号字母)
a. 加热该绿色溶液,观察颜色变化
b. 加水稀释绿色溶液,观察颜色变化
c. 向该绿色溶液中通入氮气,观察颜色变化
d. 向饱和硝酸铜溶液中通入浓硝酸与铜反映产生的气体,观察颜色变化
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com