
12.右图是铜锌原电池,某同学做完实验后记录如下:
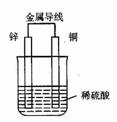 ①Zn为正极,Cu为负极 ②电解质溶液pH不变 ③电子流动的方向为:Zn→Cu ④Cu极上有氢气产生 ⑤若有1mol电子流过导线,则产生氢气0.5 mol ⑥该原电池产生氢气的速度比没有导线相连时慢
①Zn为正极,Cu为负极 ②电解质溶液pH不变 ③电子流动的方向为:Zn→Cu ④Cu极上有氢气产生 ⑤若有1mol电子流过导线,则产生氢气0.5 mol ⑥该原电池产生氢气的速度比没有导线相连时慢
上述记录中描述正确的是
A.①②③ B.①②⑥ C.③④⑤ D.④⑤⑥
11.将一定量的铁粉和硫粉的混合物共热,充分反应后冷却,再加入足量的稀硫酸,得到标准状况下的气体11.2 L,则原混合物可能的组成是(n代表物质的量)
A.n(Fe)< n(S) 总质量等于44g B.n(Fe)> n(S) 总质量等于44g C.n(Fe) = n(S) 总质量大于44g D.n(Fe)> n(S) 总质量小于44g
10.已知反应:① 2H2S + O2 → 2S + 2H2O ② 2H2S + SO2 → 3S + 2H2O
③ 2H2S + 3O2 → 2SO2 + 2H2O
将点燃的H2S气体的导管伸入盛有一定量O2的集气瓶内,上述3个反应发生的先后顺序是
A.①②③ B.③①② C.①③② D. ③②①
9.下列能用勒沙特列原理解释的是
A.合成氨中采用高温有利于生产。 B.棕红色NO2加压后颜色先变深后变浅;
C.SO2催化氧化成SO3的反应,往往需要使用催化剂;
D.H2、I2、HI平衡混和气加压后颜色变深。
8.下列反应的离子方程式中,正确的是
A.氢硫酸中滴入足量NaOH溶液:H2S + 2OH- →S2- + 2H2O
B.NaBr溶液中通入过量Cl2: Br-+ Cl2 → Br2 + Cl-
C.氯化铵溶液中加入氢氧化钠溶液:NH4Cl +
OH-→ NH3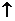 +
Cl- + H2O
+
Cl- + H2O
D.碳酸钡投入足量的稀盐酸中:CO32- + 2H+ →CO2↑+ H2O
7. 对可逆反应:N2+3H2 2NH3达平衡时,若分别增大压强和降低压强,两种情况下,对平衡体系正逆反应速率影响较大的依次是
对可逆反应:N2+3H2 2NH3达平衡时,若分别增大压强和降低压强,两种情况下,对平衡体系正逆反应速率影响较大的依次是
A.正反应速率,正反应速率 B.逆反应速率,逆反应速率
C.正反应速率,逆反应速率 D.逆反应速率,正反应速率
6.黑火药爆炸时的主要反应是:S+2KNO3 +3C →K2S +3CO2↑+N2↑,下列说法正确的是
A.上述反应的生成物都是无毒的,所以燃放爆竹时不会污染环境
B.该反应的发生需要点燃或撞击,所以它是一个吸热反应
C.硫磺在黑火药爆炸的反应中既是氧化剂,又是还原剂
D.KNO3有强氧化性,乘坐汽车、火车、飞机时不能随身携带
5.化合物A、B、C都只含有两种元素,且A、B均含X元素。已知一定条件下可发生反应:A+B--X+C,X是一种单质,由此可知X元素
A.一定是金属元素 B.一定是非金属元素 C.可能是金属元素,也可能是非金属元素 D.无法确定
4.下列关于环境问题的说法正确的是
A.燃煤时加适量的生石灰可减少二氧化硫的排放
B.pH在5.6~7.0之间的降水通常称为酸雨
C.焚烧一次性饭盒可减少白色污染
D.回收废旧电池的首要原因是回收某些金属和石墨.
3. 反应2A(g) 2B(g)+E(g) -Q,达到平衡时,要使正反应速率降低,A的浓度增大,应采取的措施是
反应2A(g) 2B(g)+E(g) -Q,达到平衡时,要使正反应速率降低,A的浓度增大,应采取的措施是
A.加压 B.减压 C.减少E的浓度 D.降温
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com